1、简答题 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体.
请回答:
(1)A中的现象______,B中的现象______;
(2)由此可知,降低温度,该化学平衡向______(填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为______,升高温度,该反应中NO2的转化率将______(填“增大”、“减小”或“不变”).
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭.
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深.
①推进针筒后颜色变深的原因是______;
②一段时间后气体颜色又变浅的原因是______;
③由此实验得出的结论是______.
(2)将第三支针筒活塞快速拉至20cm3处,该同学观察到的现象是______;在此过程中,该反应的化学平衡常数将______?(填“增大”、“减小”或“不变”,下同),NO2的转化率将______.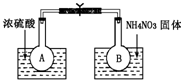
参考答案:(1)浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)?N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,故答案为:气体颜色加深,气体颜色变浅;
(2)由以上分析知,降低温度,平衡向正反应方向移动,故答案为:正;
(3)Kc=C(N2O4)C2(NO2),升高温度,平衡向逆反应方向移动,导致二氧化氮转化率降低,
故答案为:Kc=C(N2O4)C2(NO2);?减小;
Ⅱ.(1)①气体的体积减小时,NO2浓度增大,则气体颜色加深,
故答案为:气体的体积减小,NO2浓度增大,气体的颜色加深;
②气体体积减小,则气体压强增大,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,
故答案为:增大压强,减小气体的体积,平衡向正反应方向移动;
③增大压强,化学平衡向气态物质系数减小的方向移动,故答案为:增大压强,化学平衡向气态物质系数减小的方向移动;
(2)气体体积增大,二氧化氮浓度减小,所以气体颜色变浅,同时气体的压强减小,平衡向逆反应方向移动,二氧化氮的浓度增大,但仍不如第一支针筒气体的浓度大,所以仍比第一支针筒气体的颜色浅;化学平衡常数只与温度有关,温度不变,化学平衡常数不变,平衡向逆反应方向移动,所以二氧化氮的转化率减小,
故答案为:气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅,不变,减小.
本题解析:
本题难度:一般
2、选择题 在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g);△H=Q.某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
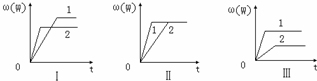
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间.其它条?件不变时,下列分析正确的是( )
(1)图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
(2)图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0
(3)图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
(4)图Ⅱ可能是在同温同压下催化剂对反应的影响,且1中使用的催化剂效果好.
A.(1)(2)
B.(1)(3)
C.(2)(4)
D.(1)(4)
参考答案:D
本题解析:
本题难度:一般
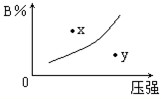
3、选择题 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
①m+n>p;②x点表示该反应的正反应速率大于逆反应速率;
③n>p;?④x点时比y点时的反应速率慢.
A.只有①
B.只有②④
C.只有①②④
D.只有①和③

 NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)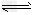 H2(g)+I2(g)。达到平衡时,c(H2)=0.5?mol/L,c(HI)=4?mol/L,则此温度下反应①的平衡常数为
H2(g)+I2(g)。达到平衡时,c(H2)=0.5?mol/L,c(HI)=4?mol/L,则此温度下反应①的平衡常数为