1、选择题 构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是
[? ]
A、E(3s)>E(2s)>E(1s)
B、E(3s)>E(3p)>E(3d)
C、E(4f)>E(4s)>E(3d)
D、E(5s)>E(4s)>E(4f)
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列微粒中,最外层是8个电子,并与Li+相差两个电子层的是( )
A.F-
B.Mg2+
C.S2-
D.Na+
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列叙述中,正确的是( )
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
D.如果某一基态3p能级上仅有2个电子,它们自旋方向必然相反
参考答案:C
本题解析:
本题难度:简单
4、选择题 2005年有科学家在《Science》上发表论文,宣布发现铝的超原子结构Al13和?Al14,并在质谱仪检测到稳定的Al13-和Al142+等.Al13、Al14的性质很像现行周期表中某些主族元素,已知当这类超原子具有40个价电子时最稳定.下列说法不正确的是( )
A.Al13与卤素原子性质相似,能形成稳定的Al13-
B.Al14与HI反应的化学方程式为:Al14+2HI═Al14I2+H2
C.Al13超原子中Al原子间是通过离子键结合的
D.Al14与ⅡA族元素性质相似,容易失去2个电子形成稳定的Al142+
参考答案:A、“超级原子”最外层电子数之和为40个时处于相对稳定状态,Al13有39个价电子极易得一个电子成稳定的Al13-,与第七主族性质相似,故A正确;
B、“超级原子”最外层电子数之和为40个时处于相对稳定状态,Al14有42个价电子极易失二个电子成稳定的Al142+,与第二主族性质相似,所以能与氢碘酸反应转化出氢气,方程式为Al14+2HI═Al14I2+H2,故B正确;
C、Al13性质与第七主族相似,为分子晶体,Al13超原子中Al原子间通过共价键结合,故C错误;
D、“超级原子”最外层电子数之和为40个时处于相对稳定状态,Al14有42个价电子极易失二个电子成稳定的Al142+,与第二主族性质相似,故D正确.
故选:C.
本题解析:
本题难度:简单
5、简答题
元素
Mn
Fe
|
电离能(?kJ?mol-1)
I1
717
759
I2
1509
1561
I3
3248
2957
|
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素价电子的电子排布式为______,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是:______
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氯和亚铁离子〔Fe(CN)64-〕中的配体CN-中C原子的杂化轨道类型是______,写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
(3)三氯化铁常温下为固体,熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁的晶体类型为:______
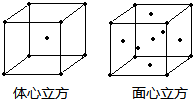
(4)金属铁的晶体在不同的温度下有两种堆积方式,晶体分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为:______.
参考答案:(1)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为3d54s2.
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
故答案为:3d54s2.?由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(2)①Fe原子或离子含有空轨道.所以,与Fe原子或离子形成配合物的分子或离子应具有孤对电子.
故答案为:具有孤对电子.
②CN-中C原子与N原子键以三键连接,三键中有1个δ键、2个π键,C原子还有一对孤对电子,杂化轨道数2,C原子采取sp杂化.
CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为氮气分子等,结构式为N≡N.
故答案为:sp;N≡N
(3)三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.符号分子晶体的特征,故为三氯化铁分子晶体.
故答案为:分子晶体.
(4)面心立方结构晶胞中铁原子数为1+6×12=4;
体心立方结构晶胞中铁原子数为1+8×18=2.
属于两种结构的铁原子数之比为4:2=2:1.
故答案为:2:1
本题解析:
本题难度:一般