1、选择题 甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。
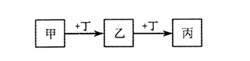
下列说法不正确的是
A.若甲是AlCl3溶液,则丁可能是NaOH溶液
B.若甲是Fe,则丁可能是Cl2
C.若丁是CO2,则甲可能为Mg
D.若丁是O2,则乙、丙的相对分子质量可能相差16
参考答案:B
本题解析:A.若甲是AlCl3溶液,向其中滴加少量的NaOH溶液时,发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl;继续滴加时,会发生反应:Al(OH)3+NaOH=NaAlO2+2H2O。正确。B.若甲是Fe,则无论Cl2量的多少,都会发生反应:2Fe+ 3Cl2 2FeCl3;后边无法发生反应。错误。C.若丁是CO2,甲为Mg,会发生反应:2Mg+ CO2
2FeCl3;后边无法发生反应。错误。C.若丁是CO2,甲为Mg,会发生反应:2Mg+ CO2 2MgO+C;CO2过量时发生反应:CO2+C
2MgO+C;CO2过量时发生反应:CO2+C 2CO;正确。D.若甲是S,发生反应:S+ O2
2CO;正确。D.若甲是S,发生反应:S+ O2 SO2,2SO2+ O2
SO2,2SO2+ O2 2SO3;SO2、SO3的相对分子质量相差16。正确。
2SO3;SO2、SO3的相对分子质量相差16。正确。
本题难度:一般
2、选择题 将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。

则原溶液中Al3+、Mg2+、NH4+的物质的量分别为 ( ?)
A.2 mol、3 mol、8 mol
B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、4 mol
参考答案:C
本题解析:
加入8molNa2O2时,根据钠原子守恒,可知n(Na+)=2n(Na2O2)=2×8mol=16mol,Na+离子所带的总电量相当于16mol×1=16mol.
A、Al3+、Mg2+、NH4+离子所带的总电量相当于2mol×3+3mol×2+8mol×1=20mol,故A错误;
B、Al3+、Mg2+、NH4+离子所带的总电量相当于3mol×3+2mol×2+8mol×1=21mol,故B错误;
C、Al3+、Mg2+、NH4+离子所带的总电量相当于2mol×3+3mol×2+4mol×1=16mol,故C正确;
D、Al3+、Mg2+、NH4+离子所带的总电量相当于3mol×3+2mol×2+4mol×1=17mol,故D错误.
故选C.
本题难度:困难
3、选择题 小明家里收藏了一件清代的铝制佛像,该佛像至今仍保存十分完好.该佛像未锈蚀的主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
参考答案:A.铝的活动性较强,属于活泼金属,易发生化学反应,故A不正确;
B.铝的氧化物不再与空气中的氧气等发生反应,故B不正确;
C.铝的化学性质比较活泼,易与氧气反应生成氧化物,故C不正确;
D.铝的化学性质比较活泼,易被氧化,但氧化铝生成一层致密的氧化物薄膜,阻止铝与氧气的接触,具有保护内部铝的作用,故D正确.
故选D.
本题解析:
本题难度:简单
4、选择题 某同学用回收的镁铝合金制取氢气。现有10.8 g镁铝合金,下列说法正确的是(?)
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间
参考答案:C
本题解析:略
本题难度:简单
5、选择题 工业上制造镁粉是将镁蒸气在气体中冷却。可作为却气体的是(?)
①空气?②CO2?③Ar?④H2?⑤N2
A.①②
B.②③
C.③④
D.④⑤
参考答案:C
本题解析:略
本题难度:简单