|
高考化学知识点总结《有关氧化还原反应的计算》答题技巧(2019年最新版)(四)
2020-07-08 01:42:59
【 大 中 小】
|
1、填空题 (16分)某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+?、Fe3+的氧化性、还原性,并对实验结果加于应用。
(1)兴趣小组通过对Fe2+、Fe3+ 的价态分析,对Fe2+、Fe3+ 的氧化性、还原性提出了如下3种假设:
假设一:Fe2+具有?性;
假设二:Fe2+具有?性;
假设三:Fe3+具有?性;
(2)设计实验方案,进行实验并描述实验现象,完成下列表格。
探究内容
| 实验方案
| ?实验现象
| 写出下列离子方程式
| 探究Fe2+具有还原性
| 取少量0.1mol·L-1FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量?
| 溶液先不变红,
后变为血红色
| ①Fe2+发生的反应:
| 探究Fe3+具有氧化性
| 取少量0.1mol·L-1FeCl3溶液,加入足量?后,再往溶液中加入少量KSCN溶液
| 溶液不变为血红色
| ②Fe3+发生的反应:
|
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2 + Zn ="=" ZnCl2 + Fe
该反应的离子方程式为:?。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:?。
参考答案:假设一:Fe2+具有?还原?性;
假设二:Fe2+具有?氧化?性;
假设三:Fe3+具有?氧化?性;
(2)
探究内容
实验方案
?实验现象
写出下列离子方程式
探究Fe2+具有还原性
再往溶液中加入少量?新制氯水?
溶液先不变红,后 变为血红色 变为血红色
①?Fe2+发生的反应:
? 2Fe2++Cl2=2Fe3++ 2Cl-?
探究Fe3+具有氧化性
加入足量
?铁粉?
溶液不变为血红色
②Fe3+发生的反应:
? 2 Fe3++ Fe= 3Fe2+?
(3)该反应的离子方程式为:? Zn+Fe2+= Zn2++ Fe?。
(4)反应的离子方程式是:? 2 Fe3++Cu= 2Fe2+ +Cu2+?
本题解析:略
本题难度:一般
2、选择题 现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
A.4 mo1
B.5 mo1
C.6 mo1
D.7 mo1
|
参考答案:A
本题解析:144克FeO的物质的量=144g÷72g/mol=2mol,反应中Cu元素化合价由+1价升高为+2价,S 元素化合价由-2升高为+6,Fe元素化合价由+2升高为+3,而N元素化合价由+5降低为+2,根据电子转移守恒:(5-2)×n(NO)=1mol×[2×(2-1)+6-(-2)]+2mol×(3-2),解得n(NO)=4mol,故A项正确。
考点:本题考查氧化还原反应的计算。
本题难度:一般
3、填空题 氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。
(1)现有8.4克氧化铜被氢气完全还原后,得到红色固体6.96克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.96克上述混合物与足量的浓硝酸充分反应:
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体20.328g。经分析,原溶液中的Cu2+有20%残留在母液中,所得晶体的化学式为 。
(3)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L HNO3溶液恰好使混合物完全溶解,同时收集到224mL NO气体(标准状况)。如原混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围(写出解题过程)。
参考答案:(1)5∶1
(2)①NO、NO2,(1分) 11∶3 (2分)
②Cu(NO3)2·3H2O(2分)
(3)n(Cu2O)=(0.015-x) mol (2分)
n(CuO)= (x-0.005) mol(2分) 0.005<x<0.015 (1分)
本题解析:(1)设单质铜与氧化亚铜的物质的量分别为x和y,则根据铜原子守恒可知x+2y=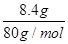 =0.105mol。又因为64g/mol×x+144g/mol×y=6.96g,解得x=0.075mol、y=0.015mol,因此单质铜与氧化亚铜的物质的量之比为5∶1。 =0.105mol。又因为64g/mol×x+144g/mol×y=6.96g,解得x=0.075mol、y=0.015mol,因此单质铜与氧化亚铜的物质的量之比为5∶1。
(2)①反应中转移电子的物质的量为0.075mol×2+0.015mol×2×1=0.18mol,气体的物质的量是1.568L÷22.4L/mol=0.07mol。设混合气中NO和NO2的物质的量分别为a mol和b mol,则a+b=0.07、3a+b=0.18,解得a=0.055mol、b=0.015mol,因此混合气的成分是NO和NO2,其体积之比为11∶3。
②设晶体的化学式为Cu(NO3)2·nH2O,则根据铜离子守恒可知晶体中铜离子的物质的量为0.105mol×80%=0.084mol,因此晶体的物质的量也是0.084mol,则0.084mol×(192+18n)g/mol=20.328g,解得n=3,即晶体化学式为Cu(NO3)2·3H2O。
(3)设Cu2O、CuO的物质的量分别为Ymol、Zmol,则根据铜原子守恒可知生成硝酸铜的物质的量为(X+2Y+Z)mol。NO的物质的量是0.01mol,则根据电子得失守恒可知2X+2Y=0.01×3=0.03。硝酸的物质的量是0.06mol,则根据氮原子守恒可知2×(X+2Y+Z)+0.01=0.06,解得Z=(x-0.005),Y=(0.015-x)。由于Y、Z均不能为0,作为X的取值范围是0.005<x<0.015。
考点:考查化学计算
本题难度:困难
4、计算题 (6分)用MnO2和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则
(1)制氯气的反应中转移了多少个电子?
(2)生成多少升氯气?
可制得漂白粉多少克?
参考答案:(1)2.048×1023 (2)4.48L (3)25.4g
本题解析:
试题解析:(1)MnO2+4HCl(浓) MnCl2+Cl2+2H2O↑,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为2.048×1023个;(2)在MnO2+4HCl(浓) MnCl2+Cl2+2H2O↑,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为2.048×1023个;(2)在MnO2+4HCl(浓) MnCl2+Cl2+2H2O↑反应中,当有0.4molHCl被氧化时,生成氯气0.2mol; MnCl2+Cl2+2H2O↑反应中,当有0.4molHCl被氧化时,生成氯气0.2mol;
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 111g 143g
0.2mol 11.1g 14.3g
则所得漂白粉的质量为11.1g+14.3g=25.4g。
考点:电子转移数目、化学方程式的计算
本题难度:一般
5、填空题 实验室需用90mL 2mol·L-碳酸钠溶液。
(1)配制该溶液时,根据你的实践经验,下列仪器不可能用到的是_____(填选项)。
A. 托盘天平 B. 烧杯 C. 胶头滴管 D. 100ml容量瓶 E. 90ml容量瓶 F.玻璃棒
(2)实验操作步骤有:A.称取碳酸钠晶体;B.用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶;C.将烧杯中的溶液转移到选定的容量瓶中;D.将碳酸钠晶体置于烧杯中用适量的水溶解,并用玻璃棒搅拌均匀;E.将配好的碳酸钠溶液装入试剂瓶待用并贴好标签;F.向容量瓶加水至刻度线1-2cm处改用胶头滴管滴加水至液面与刻度线相切;G.塞好瓶塞,反复上下颠倒摇匀。
①上述步骤的正确操作顺序是?????B?????(填写字母)
②本实验称取的碳酸钠晶体的质量是?g
③若定容时仰视刻度线,则所配溶液浓度?(填“偏大”、“偏小”或“无影响”)
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理方法是?(填选项)。
A. 吸出多余液体,使凹液面与刻度线相切
B. 小心加热容量瓶溶液,经蒸发后,使凹液面与刻度线相切
C. 经准确计算加入一定量的浓硫酸
D. 重新配制碳酸钠溶液
参考答案:(1)E?
(2)①A D C , F G E(各1分)?
②21.2?
③偏小(1分)
④D(1分)
本题解析:(1)根据容量瓶的规格可判断,答案选E
(2)①根据配制溶液的一般步骤:称、溶、移、洗、定、摇、转,可得上述步骤的正确操作顺序是A D C , F G E
②100mL 2mol·L-1碳酸钠的质量为0.1L×2mol·L-1×106g·mol-1=21.1g
③定容时仰视刻度线,会使所配溶液的体积偏大,浓度偏小
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,只能倒掉重配,答案选D。
本题难度:一般
|