1、选择题 下列表格中各项分类都正确的一组是
[?]
纯净物
混合物
电解质
非电解质
A.
小苏打
纯净的空气
硝酸
蔗糖
B.
纯碱
石油
氯化钠
铁
C.
水玻璃
水泥
二氧化硫
水
D.
盐酸
十二水和硫酸铝钾
硫酸铵
酒精
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列状态的物质,既能导电又属于电解质的是
A.KNO3晶体
B.盐酸
C.液态氯化氢
D.熔融的KOH
参考答案:D
本题解析:电解质是在水溶液里或熔化状态下能导电的化合物。A、C、D都是电解质,但是KNO3晶体中的离子不能自由移动,液态氯化氢中无离子,二者都不能导电。熔融的氢氧化钾中含有离子且能自由移动,故可以导电。盐酸是混合物,不属于电解质。所以正确选项为D。
本题难度:一般
3、选择题 下列说法正确的是?
[?]
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C.水难电离,纯水几乎不导电,所以水是弱电解质
D.溶于水能导电,熔融时不导电的电解质,自身不含有离子
参考答案:CD
本题解析:
本题难度:简单
4、选择题 下列判断不正确的是( )
A.pH=3的盐酸溶液和pH=11的氨水溶液等体积混合后溶液显碱性
B.pH=2的HA溶液与pH=12的MOH溶液任意比例混合后有:c(H+)+c(M+)═c(OH-)+c(A-)
C.0.1mol/L的NaHA溶液其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后有:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH)
参考答案:A.一水合氨为弱电解质,pH=3的盐酸溶液和pH=11的氨水溶液等体积混合时,氨水过量,混合后溶液呈碱性,故A正确;
B.溶液中电荷呈电中性,所以阴阳离子电荷相等,溶液中阴离子有OH-、A-,阳离子有H+、M+,由阴阳离子电荷守恒知,c(H+)+c(M+)=c(OH-)+c(A-),故B正确;
C.0.1mol/L的NaHA溶液其pH=4,说明HA-的电离程度大于HA-水解程度,电离:HA-?H++A2-;水HA-+H2O?H2A+OH-,则c(A2-)>c(H2A),溶液中存在水的电离,所以c(H+)>c(A2-),电离与水解程度都不大,所以,c(HA-)最大,则有c(HA-)>c(H+)>c(A2-)>c(H2A),故C错误;
D.CH3COONa水CH3COONa+H2O?CH3COOH+NaOH,CH3COOH电离:CH3COOH?H++CH3COO-,存在电荷守恒:2c(CH3COO-)+2c(OH-)=2c(H+)+2c(Na+),存在物料守恒:C(CH3COOH)+C(CH3COO-)=2(Na+),二者联式可得:C(CH3COO-)+2C(OH-)=2(H+)+C(CH3COOH),故D正确.
故选C.
本题解析:
本题难度:一般
5、选择题 某无色溶液中只可能含有Na+、Ba2+、Mg2+、Cl—、Br-、SO2-3、SO2-4,对该溶液进行下列实验,?实验操作和现象如下表:
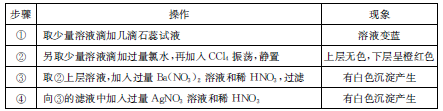
下列结论正确的是
A.可能含有Cl-、Mg2+、SO2-4
B.肯定没有Ba2+、Cl-、Br-
C.不能确定的离子有Mg2+、SO2-3-、SO2-4
D.肯定含有Na+、Br-、SO2-3
参考答案:D
本题解析:滴加石蕊试液变蓝,说明溶液显碱性,据题干可判断出,肯定有弱酸根离子:SO2-3,则不能有与其反应的微粒:Ba2+、Mg2+,但是溶液中必须有阳离子,所以肯定有Na+。滴加氯水的现象,可判断出有Br-。第三步确定不了SO2-4,因其含有SO2-3。第四步不能说明含有Cl—,因为第二步中加入了氯水。综上所述,故选D
本题难度:一般