1、填空题 (三选一)【化学—物质结构与性质】
金属铜的导电性仅次于银,大量用于电气工业。
(1)用金属键理论解释金属铜能导电的原因_______________。
(2)写出铜的基态原子核外电子排布式_______________。
(3)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为_______________。

(4)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。氨分子中N原子的杂化方式为____________?。上述深蓝色晶体中含有的化学键除普通共价键外,还有_________和___________。
参考答案:(1)金属铜晶体中的电子气在电场的作用下定向移动而导电
(2)1s22s22p63s23p63d104s1
(3)CuCl
(4)sp3;离子键;?配位键
本题解析:
本题难度:一般
2、选择题 下列分子中,中心原子不是采取sp2型杂化的是( )
A.BCl3
B.PCl3
C.C2H4
D.C6H6
参考答案:B
本题解析:
本题难度:一般
3、选择题 在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A.sp,范德华力
B.sp2,范德华力
C.sp2,氢键
D.sp3,氢键
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列物质的化学用语正确的是( )
A.NH4H的电子式:
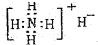
B.硝基苯的结构简式:

C.甲烷分子的比例模型:
D.sp2杂化轨道模型:

参考答案:D
本题解析:
本题难度:简单
5、简答题 根据杂化理论回答下列问题。

(1)上表中各物质中心原子是否以杂化轨道成键?以何种类型杂化轨道成键?
_______________________________
(2)NH3和H2O的键角为什么比CH4小?CO2的键角为何是180°?C2H4的键角又为何是120°?
_______________________________
参考答案:(1)表中所给物质中心原子都是以杂化轨道与其他原子成键的。 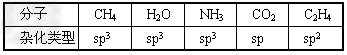 (2)NH3和H2O分子中N和O原子都是采取sp3杂化,但有的杂化轨道中由原子本身的孤对电子占据着,电子云密度大,对其他成键的电子的杂化轨道有排斥作用,所以NH3和H2O的键角被压缩而小于109.5°。CO2分子中C原子是以sp杂化的,形成两条sp-pσ键,分子为直线形。在C2H4分子中,两个C原子都采取sp2等杂化,两原子各以一个sp2杂化轨道相连形成sp2-sp2σ键;另外每个C原子各有一个未参加杂化的p轨道,与sp2杂化轨道平面平行,“肩并肩”形成π键,所以C与C之间是一个双键(一条σ键,一条π键);每个C原子剩下两个sp2杂化轨道分别与H原子的s轨道形成sp2-sσ键,所以C2H4分子中C-H键的键角为120°。
(2)NH3和H2O分子中N和O原子都是采取sp3杂化,但有的杂化轨道中由原子本身的孤对电子占据着,电子云密度大,对其他成键的电子的杂化轨道有排斥作用,所以NH3和H2O的键角被压缩而小于109.5°。CO2分子中C原子是以sp杂化的,形成两条sp-pσ键,分子为直线形。在C2H4分子中,两个C原子都采取sp2等杂化,两原子各以一个sp2杂化轨道相连形成sp2-sp2σ键;另外每个C原子各有一个未参加杂化的p轨道,与sp2杂化轨道平面平行,“肩并肩”形成π键,所以C与C之间是一个双键(一条σ键,一条π键);每个C原子剩下两个sp2杂化轨道分别与H原子的s轨道形成sp2-sσ键,所以C2H4分子中C-H键的键角为120°。
本题解析:
本题难度:一般