1、选择题 下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 (?)

A.上下移动①中铜丝可控制SO2的量
B.②中品红溶液不褪色
C.③中石蕊溶液变蓝色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
参考答案:A
本题解析:在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B不正确;SO2为酸性气体,溶于水显酸性,能使石蕊溶液变红色,故C不正确;铜与浓硫酸的反应Cu+2H2SO4 ?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
点评:该题是中等难度的试题,试题基础性强,紧扣教材,意在巩固学生的基础,提高学生的实验分析和探究能力,有利于培养学生的学习兴趣,激发学生的学习积极性。答题时注意二氧化硫的酸性和漂白性。
本题难度:简单
2、简答题 电石浆是氯碱工业中的一种废弃物,其大致组成如表所示:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质
质量分数(%)
65~66
3.5~5.0
1.5~3.5
0.2~0.8
0.2~1.1
1.0~1.8
23-26
|
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
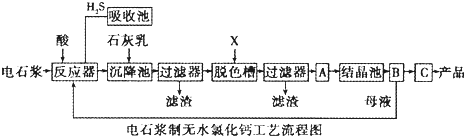
已知氯化钙晶体的化学式是:CaCl2?6H2O;H2S是一种酸性气体,且具有还原性.
(1)反应器中加入的酸应选用______.
(2)脱色槽中应加入的物质X是______;设备A的作用是______;设备B的名称为______;设备C的作用是______.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是______.反应的化学方程式为______.
A.水B.浓硫酸C.石灰乳D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______.
(5)氯碱工业电极方程式______.
参考答案:(1)因要生产CaCl2,过程中不引入新的杂质离子,所以应选用盐酸,故答案为:盐酸;
(2)活性炭具有吸附性,可以进行溶液脱水.A后是结晶池,故A应为蒸发浓缩;从B中有母液出来,故B为过滤器.B中得到晶体,所以需要脱水干燥,才能得到CaCl2产品,
故答案为:活性炭;蒸发浓缩;过滤器;脱水干燥;
(3)H2S为酸性气体,应用碱液吸收,故选石灰乳,反应的化学方程式为Ca(OH)2+H2S=CaS+2H2O,
故答案为:C;Ca(OH)2+H2S=CaS+2H2O;
(4)设备B中产生的母液含有氯化物,回收利用,可以降低废弃物排放量,提高经济效益,
故答案为:对母液回收利用,降低废弃物排放量,提高经济效益;
(5)氯碱工业中电解饱和食盐水,阳极是氯离子失电子生成氯气,电解反应为:2Cl--2e-=Cl2↑,阴极是氢离子得到电子生成氢气,电解反应为:2H++2e-=H2↑;
故答案为:阳极为2Cl--2e-=Cl2↑,阴极为2H++2e-=H2↑.
本题解析:
本题难度:一般
3、实验题 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL
6mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是_____________________。
(2)如何检验铁片已经洗净___________________________________。
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为Scm2、质量为mg的镀锌铁皮放入
6mol·L-1NaOH溶液中。回答下列问题

(3)装置中导管a的作用是_____________________。
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②待B中不再有气体产生并恢复至室温;
③由A向B中滴加足量NaOH溶液;
④上下移动C,使干燥管和C中液面相平。
上述操作的顺序是______________(填序号)。
(5)实验前后碱式滴定管中液面读数分别为V1mL、V2mL(已知Zn的密度为7.14g/cm3,实验条件的气体摩尔体积为VmL/mol。则镀锌铁皮的镀层厚度为_______cm。(写出数学表达式)
参考答案:(1)反应速率突然减小
(2)取最后一次洗出液,滴加AgNO3溶液,若无白色沉淀,则铁片已洗净(或用玻璃棒蘸取最后一次洗出液,滴在蓝色石蕊试纸上,若不变红色,则铁片已洗净)
(3)使分液漏斗和锥形瓶内气压相同,NaOH溶液能顺利滴下
(4)④①③②④①
(5)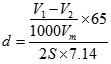
本题解析:
本题难度:困难
4、实验题 应用下图所示装置(部分夹持装置已省略),在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。

请完成该实验中的问题:
(1)写出该反应的化学方程式:__________________。该氧化还原反应的还原剂是____,氧化剂是____。
(2)实验前必须对整套装置进行气密性检查,操作方法是______________。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_____________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_________。
(4)酒精灯和酒精喷灯点燃的顺序是_____________,为什么?__________________。
(5)干燥管中盛装的物质是________,作用是_________。
(6)试管中收集的气体是______________。如果要在A处的玻璃管处点燃该气体,则必须对该气体进行_________,方法是______________,这一操作的目的是______________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2;Fe;H2O
Fe3O4+4H2;Fe;H2O
(2)在A处玻璃管口接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则表明该套装置气密性良好
(3)提供持续不断的水蒸气;防止暴沸
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止先点燃酒精喷灯导致Fe与O2反应
(5)碱石灰(答案合理均可);除去反应产生的H2中混有的水蒸气
(6)H2;验纯;用向下排空气法收集一试管气体,用拇指堵住试管口,管口向下移近酒精灯火焰,松开拇指,如果发出爆鸣声,则证明产生的氢气不纯(含有空气),如果是“噗”的声音,则证明是纯净的氢气;防止点燃时,氢气中含有氧气而爆炸
本题解析:
本题难度:一般
5、填空题 可用一种试剂把NaOH溶液、Na2CO3溶液和Ba(OH)2溶液三种无色溶液鉴别出来,该试剂为______(填化学式).
参考答案:NaOH溶液、Na2CO3溶液和Ba(OH)2溶液三种无色溶液,与硫酸(或硫酸氢钠)反应的现象分别为:无现象、有气体生成、有沉淀生成,现象不同,可以鉴别,
则该试剂的化学式为H2SO4或NaHS04,故答案为:H2SO4或NaHS04.
本题解析:
本题难度:简单