1、选择题 分析下面的能量变化示意图,下列热化学方程式正确的是
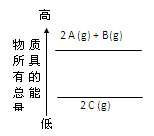
A.2A(g)+ B(g)=2C(g);△H=a(a>0)
B.2A(g)+ B(g)=2C(g);△H=a(a<0)
C.2A + B="2" C;△H=a(a<0)
D.2C="2A" +B;△H=a(a>0)
参考答案:B
本题解析:考查热化学方程式的书写。根据图像可知,A和B的总能量高于C的总能量,所以A和B生成C的反应是放热反应,其逆反应就是吸热反应。所以选项A不正确,选项C和D中没有注明反应物的状态,一定不正确。答案选B。
本题难度:一般
2、选择题 下列过程中的能量转化,属于光能转化为化学能的是( )
A.石油燃烧
B.植物的光合作用
C.核电站发电
D.太阳能电池供电
参考答案:A.石油燃烧是化学能转化成热能与光能,,故A错误;
B.植物的光合作用是光能转化成化学能,故B正确;
C.核电站发电是核能转化成电能,故C错误;
D.太阳能电池供电是太阳能转化成电能,故D错误.
故选B.
本题解析:
本题难度:简单
3、计算题 常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
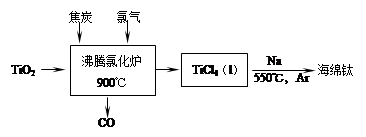
① 沸腾氯化炉中发生的主要反应为:??。
②已知:Ti(s) +2Cl2(g)=TiCl4(l)?ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s)?ΔH=b kJ·mol-1;
Na(s)=Na(l)?ΔH=c kJ·mol-1;
则TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s)?ΔH=?kJ·mol-1。
③ TiCl4遇水强烈水解,写出其水解的化学方程式?。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电?极,该极电极反应为:?。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种还原性气体,该气体是?。

(3)海绵钛可用碘提纯,原理为: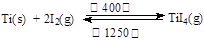 ,下列说法正确的是?。
,下列说法正确的是?。
A.该反应正反应的ΔH>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2 可循环利用
参考答案:
(1)①TiO2+2C+2Cl2=TiCl4+2CO(高温或900℃要注明);②2b-4c-a;
③TiCl4 + 4H2O=Ti(OH)4↓+ 4HCl↑
(2)负? TiO2 +4e-=Ti + O2-(或:Ca2++2e-=Ca;2Ca+TiO2=2CaO +Ti) H2
(3)C D(只选对1个给1分,错选0分)
本题解析:化学反应原理的基本内容。
(1)①根据图中箭头指向判断反应物和生成物,利用氧化还原反应配平方程式;②把三个方程式2②-4③-①即可以得到;
(2)该电解池是用二氧化钛生产金属钛的工艺,电解时钛元素由+4变为0价,得到电子,为阴极,连接电源的负极,还可以根据O2-聚集判断;但此法会有石墨失去电子产生CO,改用金属陶瓷电极需加入还原性气体提供电子,故通入H2;
(3)A、根据反应方程式判断低温正向进行高温逆向进行,故正向为放热反应,ΔH<0,错误;B、温度不同,平衡发生移动,TiI4的量随着发生变化,错误;C、低温碘单质与钛反应生成气态TiI4,高温下分解得到金属钛和碘单质,所以说I2 的作用是将粗钛从低温区转移到高温区,在该过程中I2 可循环利用正确,故C、D都正确。
本题难度:一般
4、选择题 化学反应一般均会伴随着能量变化,对CH4在O2中燃烧的反应,正确的是
A.该反应为吸热反应
B.该反应为放热反应
C.断裂C-H键吸收能量
D.生成H-O键吸收能量
参考答案:BC
本题解析:甲烷燃烧是放热反应,A不正确,B正确。断键是吸热的,形成化学键是放热的,C正确,D不正确,答案选BC。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练。有利于培养学生灵活运用基础知识解决实际问题的能力,提高学生的应试能力。该题的关键是明确反应热的含义和计算依据,并能结合题意灵活运用即可。
本题难度:简单
5、选择题 已知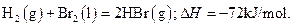 ?蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
?蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:

则表中a为
A.404
B.260
C.230
D.200
参考答案:D
本题解析:略
本题难度:简单