1、填空题 (15分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语
回答下列问题:
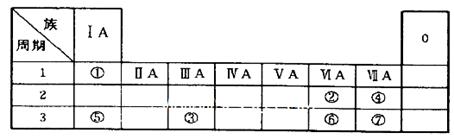
(1)④、⑤、⑦的原子半径由大到小的顺序为_______(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______>_______。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe+氧化,写出该反应的离子方程式_______。
(4)由表中元素形成的物质可发生如图中的反应,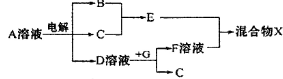
其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式______________.
②写出检验A溶液中溶质的阴离子的方法:______________.
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为_______mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有_______ 。
参考答案:(1) Na>Cl>F?;?(2)HClO4>H2SO4?;?(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4) ①2Al+2NaOH+2H2O=2NaAlO2+3H2↑?;?②取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成; ③0.01; ④Al(OH)3? H2O? NaCl。
本题解析:根据元素在周期表中的位置可推知:①的H;②是O;③是Al;④是F;⑤是Na;⑥是S;⑦是Cl。(1)同一周期的元素,原子序数越小,原子半径越大;不同周期的元素,原子核外电子层数越多,原子半径就越大。所以这几种元素的原子半径由大到小的顺序为Na>Cl>F;(2)元素的非金属性Cl>S.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以S、Cl的最高价含氧酸的酸性强弱为HClO4>H2SO4;(3) H2O2在酸性溶液中能将Fe+氧化,该反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O;(4)根据图示个物质的关系可知:A是NaCl ;B是Cl2;C是H2;D是NaOH;E是HCl;G是Al;F是NaAlO2;X是NaCl与AlCl3的混合物。①NaOH溶液与Al单质反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;②检验Cl-的方法是取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成,就证明含有Cl-;③NaCl溶液电解的方程式是:2NaCl+2H2O Cl2↑+H2↑+2NaOH 。pH=12,c(NaOH) =0.01mol/L,n(NaOH)=0.01mol。根据反应方程式可知:每产生1mol的NaOH,单质转移1mol。由于产生了0.01mol的NaOH,所以转移电子0.01mol。④若上图中各步反应均为恰好完全转化,假设有2mol的NaCl,则产生NaOH为2mol;Cl2和H2都是1mol.二者反应得到的HCl是2mol; NaOH发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑得到2mol的NaAlO2。在发生反应:NaAlO2+HCl+H2O = Al(OH)3↓+NaCl。所以混合物X中含有的物质有Al(OH)3、NaCl、H2O.
Cl2↑+H2↑+2NaOH 。pH=12,c(NaOH) =0.01mol/L,n(NaOH)=0.01mol。根据反应方程式可知:每产生1mol的NaOH,单质转移1mol。由于产生了0.01mol的NaOH,所以转移电子0.01mol。④若上图中各步反应均为恰好完全转化,假设有2mol的NaCl,则产生NaOH为2mol;Cl2和H2都是1mol.二者反应得到的HCl是2mol; NaOH发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑得到2mol的NaAlO2。在发生反应:NaAlO2+HCl+H2O = Al(OH)3↓+NaCl。所以混合物X中含有的物质有Al(OH)3、NaCl、H2O.
本题难度:一般
2、选择题 下列分散系属于胶体的是
A.FeCl3溶液
B.CuSO4溶液
C.碘酒
D.有色玻璃
参考答案:D
本题解析:
本题难度:一般
3、选择题 某元素最高价氧化物对应水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A.HX
B.H2X
C.XH3
D.XH4
参考答案:B
本题解析:考查元素周期律的应用。元素最高价氧化物对应水化物的化学式是H2XO4,则最高价是+6价,因此最低负价是-2价,选项B正确。答案选B。
本题难度:一般
4、选择题 除去NaCl中混有的 MgCl2、Na2SO4时选用
A.NaOH、Ba(NO3) 2、Na2CO3、HCl
B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl
C.NaOH、BaCl2、Na2CO3、HCl
D.Na2CO3、BaCl2、HCl
参考答案:C
本题解析:试题分析:因为反应要在溶液中进行,所以要先配制成溶液,然后除去硫酸根离子,再除钙离子和镁离子,最后加入盐酸除去过量的碳酸根和氢氧根.
故答案为:(1)将粗盐溶于足量水中制成溶液.
(2)向上述溶液中加入足量的BaCl2溶液,除去SO42-,Na2SO4+BaCl2=BaSO4↓+2NaCl,过滤,除去滤渣.
(3)向上述虑液中加入足量的Na2CO3溶液,除去Ba2+, Na2CO3+BaCl2=BaCO3↓+2NaCl,过滤,除去滤渣.
(4)向(3)虑液中加入足量的NaOH溶液,除去Mg2+,2NaOH+MgCl2=Mg(OH)2↓+2NaCl,过滤,除去滤渣.
(5)向(4)虑液中滴加稀盐酸,调节PH=7,除去CO32-和OH-,Na2CO3+2HCl=H2O+CO2↑+2NaCl,NaOH+HCl=NaCl+H2O.
(6)将NaCl溶液蒸发,洗涤干燥,即得较纯净的食盐。
故选C。
考点:物质除杂或净化的探究 盐的化学性质
点评:除杂一般有两种方法,将杂质彻底除去或将杂质转化为主物质,所选物质不能与主物质发生反应,也不要在除去杂质的同时又混入了其它物质。要注意除杂质的顺序。
本题难度:简单
5、选择题 下列排列顺序正确的是
①沸点:H2Se>H2S>H2O?②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4?④离子还原性:S2->Cl->Br-
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:考查金属性和非金属性强弱比较:
1.元素在周期表中的相对位置
①同周期元素,自左向右,元素的非金属性依次增强;②同主族元素自上而下,非金属性依次减弱;
2.非金属单质与氢气化合的越容易,非金属性越强;
3.气态氢化物的越稳定,非金属性越强;
①分子化合物的熔沸点和分子间作用力有关,相对分子质量越大,分子间作用力越大,但水分子间存在氢键,水的沸点最高;沸点:H2O>H2Se>H2S;
③非金属性越强,所对应的元素最高价氧化物的水化物的酸性越强,酸性:HClO4>H2SO4>H3PO4
本题难度:一般