1、选择题 下列图示与对应的叙述相符的是
[? ]
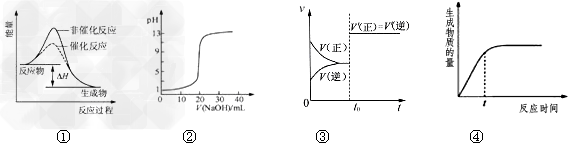
A.图①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图②表示0.1000?mol/LNaOH溶液滴定20.00mL?0.1000?mol/LHCl溶液所得到的滴定曲线
C.图③表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
D.图④表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列实验操作中,错误的是( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加适量的水搅拌溶解
B.铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次
D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
参考答案:D
本题解析:
本题难度:一般
3、填空题 某学生欲用已知物质的量浓度的盐酸来滴定并测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填空:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______,直到因加入一滴盐酸后,溶液由______变为______,并且半分钟内不恢复.
(2)下列操作中,可能使所测氢氧化钠溶液的浓度值偏低的是______
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠
溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)
滴定前刻度
滴定后刻度
溶液体积/mL
第一次
25.00
0.00
26.11
26.11
第二次
25.00
1.56
30.30
28.74
第三次
25.00
0.22
26.31
26.09
|
请选用其中合理的数据计算出该氢氧化钠溶液的物质的量浓度:c(NaOH)=______.
参考答案:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由红色突变为无色,且半分钟内不褪色,且半分钟内不褪色,
故答案为:锥形瓶中溶液颜色的变化;红色;无色;
(2)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏大,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏大,故C错误;
D.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏低,故D正确;
故选D;
(3)根据数据的有效性,舍去第2组数据,则1、3组平均消耗V(盐酸)=26.11mL+26.09mL2=26.10mL,
根据反应方程式 HCl+NaOH═NaCl+H2O
0.0261L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=0.0261L×0.1000mol/L0.025L=0.1044mol/L,
故答案为:0.1044mol/L.
本题解析:
本题难度:一般
4、简答题 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
①若要进行中和滴定实验,还缺少的玻璃仪器是______.
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是______.
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液?B.淀粉溶液?C.NaOH溶液?D.稀H2SO4?E.氯水.
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色.
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号)______.
(3)众所周知,氢气燃烧生成水.然而,资料表明,氢气燃烧时除生成水外,还生成另一产物.某同学用如图所示的实验装置,验证该产物的存在.实验步骤及现象如下:制H2、验纯,将火焰对着冰块.
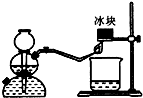
①在小烧杯内加入用硫酸酸化的稀KI淀粉溶液,将小烧杯放在冰块下方,
观察到烧杯中溶液由无色变成了蓝色.
②在另一个小烧杯内加入用硫酸酸化的稀KMn04溶液,将小烧杯放在冰块下方,观察到烧杯中溶液变成了无色.请你写出另一产物的结构式:______;
由上述实验中可以归纳出该产物的化学性质有______.
参考答案:(1)①因中和滴定实验的玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶,故答案为:锥形瓶;
②因配制一定物质的量浓度的碳酸钠溶液需要的仪器有托盘天平、药匙、烧杯、玻璃棒、一定规格的容量瓶、胶头滴管,故答案为:胶头滴管;
(2)KI溶液和氯水反应生成单质碘,碘溶于水呈棕黄色,碘遇淀粉溶液,溶液变蓝,碘与NaOH溶液反应生成碘化钠、碘酸钠和水,蓝色褪去,碘化钠和碘酸钠在酸性条件下生成单质碘,溶液变蓝,故答案为:A→E→B→C→D;?
(3)因过氧化氢在酸性条件下能氧化KI,生成单质碘,溶液变蓝,过氧化氢体现了氧化性;因KMn04溶液在酸性条件下能氧化过氧化氢,溶液褪色,过氧化氢体现了还原性,
故答案为:H-O-O-H;氧化性和还原性.
本题解析:
本题难度:一般
5、填空题 (一)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶于水中,制成稀溶液,然后向该溶液中逐滴加入1 mol/L盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示
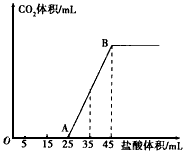
(1)写出OA段所发生反应的离子方程式_________________。
(2)当加入35mL盐酸时,产生二氧化碳的体积为___________mL (标准状况)。
(3)原混合物中Na2CO3的质量分数为____________。
(二)氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)2NH3(g) ;△H = - 92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
(4)下列方法不适合实验室制取氨气的是____(填序号)。
A.向生石灰中滴加浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴加浓氢氧化钠溶液
(5)合成氨工业中采取的下列措施可用勒夏特列原理解释的是__________(填序号)。
A.采用较高压强(20 MPa~50 MPa) B.采用500℃的高温
C.用铁触媒作催化剂 D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(6)用数字化信息系统DIS(如下图I所示:它由传感器、数据 采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.500 0mol/L醋酸溶液25.00 mL于烧杯中,用该氨水进行滴定,计算机屏幕上显示出溶液的导电能力随氨水体积变化的曲线如图Ⅱ所示。
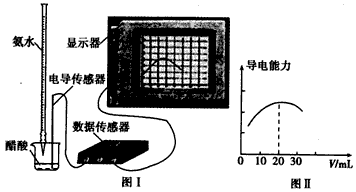
①用滴定管盛氨水前,滴定管要用_____________润洗2~3遍。
②试计算该氨水的浓度:__________________。
③下列情况下,会导致实验结果c(NH3·H2O)偏低的是________________。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,不慎将氨水滴在烧杯外
(7)1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。

正极的电极反应式为___________________________
参考答案:
(1)H++OH-=H2O,CO32-+H+=HCO3-
(2)224
(3)42.4%
(4)CD
(5)AD
(6)①上述待测氨水;②0. 6250mol/L;③AC
(4)N2+6e-=2N3-
本题解析:
本题难度:困难