| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《离子方程式的书写及正误判断》高频考点预测(2019年最新版)(八)
参考答案:C 本题解析:A不正确,电子的得失不守恒;B不正确,反应物还有水参加;D不正确,生成物是硫酸铁、硫酸亚铁和水,所以正确的答案选C。 本题难度:困难 3、选择题 下列离子方程式正确的是 |
参考答案:B
本题解析:A不正确,碳酸钙不溶于水,用化学式表示,C中电子得失不守恒,D中应该生成亚铁离子,所以正确的答案选B。
本题难度:一般
4、填空题 分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 | 需加入的试剂 | 有关离子方程式 |
| (1)HNO3(H2SO4) | | |
| (2)Cu(Fe) | | |
| (3)NaCl(Na2CO3) | | |
参考答案:
Ba(NO3)2
Ba2++SO42-=BaSO4↓
HCl
Fe+2H+=Fe2++H2↑
HCl
2H++CO32-=CO2↑+H2O
本题解析:①加入的试剂:硝酸钡.硝酸钡和稀硫酸反应生成硫酸钡沉淀和硝酸.化学方程式为:H2SO4+Ba(NO3)2
本题难度:一般
5、填空题 (16分)氮及其化合物在化学实验中有广泛应用:
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式: ;
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论: ;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式: ;
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7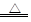 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是 ;
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂);
③写出该法验证NH3和O2存在的实验原理的化学方程式: 。
参考答案:(1)3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O(2分); (2)取少量待测固体(或先配制成浓溶液亦可)于试管中,加入过量浓的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,产生无色有刺激性气味的气体,且试纸变蓝,则原溶液含有NH4+;(4分);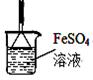
(3)(NH4)2Cr2O7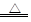 Cr2O3+N2↑+4H2O(2分);(4)①缓冲气流,防止固体被气流带进入导管,堵塞导管(2分) ②如图所示(试剂和仪器各1分,共2分)③2NH3+2H2O+FeSO4=Fe(OH)2↓+(NH4)2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3 (4分,每个反应2分,或总的反应:8NH3+10H2O+4FeSO4+O2=4Fe(OH)3↓+ 4(NH4)2SO4也同样给4分)。
Cr2O3+N2↑+4H2O(2分);(4)①缓冲气流,防止固体被气流带进入导管,堵塞导管(2分) ②如图所示(试剂和仪器各1分,共2分)③2NH3+2H2O+FeSO4=Fe(OH)2↓+(NH4)2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3 (4分,每个反应2分,或总的反应:8NH3+10H2O+4FeSO4+O2=4Fe(OH)3↓+ 4(NH4)2SO4也同样给4分)。
本题解析:(1)Cu和稀硝酸反应制备NO的离子方程式为:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O。(2)NH4+的检验通常是加强碱将其转化为NH3,再检验NH3,具体操作为:取少量待测固体(或先配制成浓溶液亦可)于试管中,加入过量浓的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,产生无色有刺激性气味的气体,且试纸变蓝,则原溶液含有NH4+。(3)(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O,知道了反应物和生成物,则化学方程式为:(NH4)2Cr2O7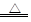 Cr2O3+N2↑+4H2O。(4)①加热时固体物质可能下来堵塞导管,在气体检验时气体的流速均匀有利于实验的操作,故试管口玻璃纤维的作用是:缓冲气流,防止固体被气流带进入导管,堵塞导管。②要检验NH3和O2根据所提供的试剂最好选FeSO4溶液,实验现象明显,NH3溶于水使的溶液显碱性,碱性溶液中FeSO4会生成Fe(OH)2,Fe(OH)2溶液被O2氧化生成红褐色的Fe(OH)3,有气体反应为了防止溶液倒吸,需要采取防倒吸的装置,则装置为:
Cr2O3+N2↑+4H2O。(4)①加热时固体物质可能下来堵塞导管,在气体检验时气体的流速均匀有利于实验的操作,故试管口玻璃纤维的作用是:缓冲气流,防止固体被气流带进入导管,堵塞导管。②要检验NH3和O2根据所提供的试剂最好选FeSO4溶液,实验现象明显,NH3溶于水使的溶液显碱性,碱性溶液中FeSO4会生成Fe(OH)2,Fe(OH)2溶液被O2氧化生成红褐色的Fe(OH)3,有气体反应为了防止溶液倒吸,需要采取防倒吸的装置,则装置为: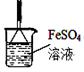
③根据上述分析NH3和O2与FeSO4反应的化学方程式为:2NH3+2H2O+FeSO4=Fe(OH)2↓+(NH4)2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3
考点:化学方程式的书写、物质的检验试剂的选择、实验装置的绘制。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《碳族元素》高频考.. | |