1、计算题 如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:
2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
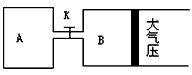
(1)B中X 的转化率α(X)B为?
(2)A中W和B中Z的物质的量的比较: n(W)A? n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为? 升 (用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是?
参考答案:(1)90%
(2)<
(3)0.35a
(4)升高温度
本题解析:
本题难度:困难
2、选择题 在恒温条件下,一定体积的容器中放入3L气体R和2L气体Q,在一定条件下发生反应:4R(g)+3Q(g) 
 ?2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,则反应中方程式的n值是
?2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,则反应中方程式的n值是
A.4
B.5
C.6
D.7
参考答案:A
本题解析:由于反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,即该反应的正反应方向为气体体积减少的方向,即n值必小于5,所以正确选项为A;
本题难度:一般
3、选择题 对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是(?)
pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是(?)
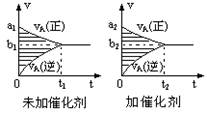
A.b1>b2 t1>t2
B.b1<b2t1<t2
C.两图中阴影部分面积相等
D.图II中阴影部分面积更大
参考答案:C
本题解析:由图象可知,加入催化剂,反应速率增大,但催化剂只影响反应速率,不影响平衡移动,以此解答该题.加入催化剂的结果一是正、逆反应速率都增大,二是缩短了达到平衡的时间。由此可得:a1<a2、b1<b2、t1>t2,但不使平衡移动推知,阴影面积为反应物浓度的变化,由于催化剂不影响平衡移动,则两图中阴影部分面积相等。故选C。
点评:考查了催化剂对化学反应速率和平衡移动的影响,以图象题题目的形成考查,题目难度不大,注意分析图象的涵义。
本题难度:简单
4、选择题 一定条件下,可逆反应X (g) + 3 Y (g) 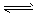 2Z (g) ,若X、Y、Z起始浓度分别为C1、C2、C3、(均不为0),平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z (g) ,若X、Y、Z起始浓度分别为C1、C2、C3、(均不为0),平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
[? ]
A.C1:C2 = 1:3
B.X、Y的转化率不相等
C.平衡时,Y与Z的生成速率之比为3:2
D.C1的取值范围为0<C1<0.14
参考答案:B
本题解析:
本题难度:一般
5、选择题 对于反应2SO2+O2 2SO3下列判断正确的是
2SO3下列判断正确的是
A.2 mol SO2和足量的O2反应,必生成2 mol SO3
B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2
C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍
D.平衡时SO2的浓度必为O2浓度的2倍
参考答案:C
本题解析:A.由于该反应是可逆反应,反应不可能完全进行,所以2 mol SO2和足量的O2反应,产生的SO3的物质的量必然小于2 mol。错误。B.物质在反应变化时这几种物质的SO2、O2、SO3的分子数之比为2∶1∶2,但是平衡时不一定是这种关系。错误。C.因为在平衡时任何物质的消耗速率与产生速率相同。在任何时刻SO2的消耗速率必定等于O2的消耗速率的2倍。SO2的消耗速率等于O2生成速率的2倍,则说明O2的消耗速率等于O2生成速率,因此反应达到平衡状态。正确。D.如果起始加入的SO2、O2的物质的量的比为2:1,因为在反应过程中二者的消耗的比为2:1,所以平衡时SO2的浓度为O2浓度的2倍。若加入的比例不是2:1,则达到平衡时SO2的浓度就不是O2浓度的2倍。错误。
本题难度:一般