|
高考化学知识点整理《反应速率与平衡的有关计算》高频考点预测(2019年最新版)(八)
2020-07-28 04:10:31
【 大 中 小】
|
1、选择题 反应2X(g)+Y(g)  ?2Z(g)△H﹤0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2—16所示。则下述判断正确的是(?) ?2Z(g)△H﹤0,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图2—16所示。则下述判断正确的是(?)
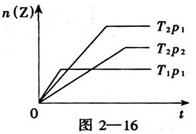
A.T1<T2,p1<p2
B.T1<T2,p1>p2
C.T1>T2,p1>p2
D.T1>T2,p1<p2
参考答案:C
本题解析:根据图像可知,当压强相等时,温度为T1的曲线首先到达平衡状态,这说明T1>T2;同样分析可知,当温度相等时,压强为P1的曲线首先到达平衡状态,这说明p1>p2,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重考查学生的能力。在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
2、选择题 2SO2(g)+O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示: 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
?
| 甲
| 乙
| 丙
| 丁
| 起始物质的量
| n(SO2)/mol
| 0.40
| 0. 40
| 0.80
| 0
| n(O2)/mol
| 0.24
| 0.48
| 0.48
| 0.04
| n(SO3)/mol
| 0
| 0
| 0
| 0.40
| 含硫反应物的平衡转化率/%
| 80
| α1
| α2
| α3
|
?
下列判断中,正确的是(?)
A.丁中SO3的平衡转化率为α3=80%
B.该温度下,平衡常数的值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率小于乙中O2的转化率
参考答案:B
本题解析:2SO2(g) + O2(g)  ?2SO3(g) ?2SO3(g)
起始/mol 0.40?0.24? 0
转化/mol? 2x?x? 2x
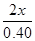 ×100%=80%,x=0.16 ×100%=80%,x=0.16
K= =400,B正确;C项,丙相当于把甲的体积缩小一半,平衡右移,所以丙中c(SO3)比甲中的2倍多,错误;D项,乙中增大O2的浓度,其自身转化率减小,错误;A项,丁和甲是等效平衡,甲平衡时SO3为0.32 mol,所以丁中SO3分解了0.40 mol-0.32 mol=0.08 mol,其转化率为 =400,B正确;C项,丙相当于把甲的体积缩小一半,平衡右移,所以丙中c(SO3)比甲中的2倍多,错误;D项,乙中增大O2的浓度,其自身转化率减小,错误;A项,丁和甲是等效平衡,甲平衡时SO3为0.32 mol,所以丁中SO3分解了0.40 mol-0.32 mol=0.08 mol,其转化率为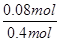 ×100%=20%,错误。 ×100%=20%,错误。
本题难度:一般
3、选择题 在一恒容密封容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g),下图所示是某一段时间内反应速率与反应进程的曲线关系图。完成下列问题: 2SO3(g),下图所示是某一段时间内反应速率与反应进程的曲线关系图。完成下列问题:
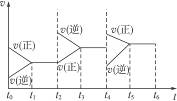
(1)处于平衡状态的时间段有____________。
(2)起始时投入的物质成分为____________。
A.SO2,O2
B.SO2,SO3
C.SO3
D.SO2,O2,SO3
| (3)t2—t3、t4—t5时间段平衡的移动方向分别为____________、____________。(填“正反应方向”或“逆反应方向”)
参考答案:(1)t1—t2,t3—t4,t5—t6? (2)D? (3)逆反应方向?正反应方向
本题解析:(1)从v的角度看,平衡时v(正)=v(逆)(平衡状态的直接标志之一)。故达平衡的时间段有:t1—t2,t3—t4,t5—t6。
(2)因t0时v(正)、v(逆)均大于0(这个细节不要忽视!),故反应物和生成物均有。答案为D。
(3)平衡被破坏时,主要发生何种反应,平衡即向该反应方向移动(移动方向的判断标准)。因t2、t4两时刻分别为:v(逆)>v(正)、v(正)>v(逆),故移动方向分别为逆反应方向和正反应方向。
本题难度:简单
4、填空题 水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH="+131" kJ·mol-1 CO (g)+H2 (g) ΔH="+131" kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器
编号
| c(H2O)
/mol·L-1
| c(CO)
/mol·L-1
| c(H2)
/mol·L-1
| v正、v逆比较
| Ⅰ
| 0.06
| 0.60
| 0.10
| v正=v逆
| Ⅱ
| 0.06
| 0.50
| 0.40
| ①
| Ⅲ
| 0.12
| 0.40
| 0.80
| v正<v逆
| Ⅳ
| 0.12
| 0.30
| ②
| v正=v逆
|
?
① ,② ?。?
在T温度下该反应的化学平衡常数为 ? 。?
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。?
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)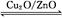 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。? CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?
参考答案:(1)①v正<v逆 ②0.40 1.00
(2)25% 不变 (3)向右 向左 向左
本题解析:(1)根据Ⅰ可知,K=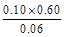 =1.00,Ⅱ中Q= =1.00,Ⅱ中Q=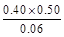 = =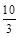 >K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)="a" mol·L-1,则 >K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)="a" mol·L-1,则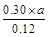 =1.00,解得a=0.40。 =1.00,解得a=0.40。
(2) C(s)+H2O(g) CO(g)+H2(g) CO(g)+H2(g)
起始量(mol) ? 1.0
转化量(mol) ? x? x? x
平衡量(mol) ? 1.0-x? x? x
所以有1.0-x+x+x=1.25×1.0
解得x=0.25
所以转化率是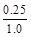 ×100%=25% ×100%=25%
碳是固体,所以增加碳的质量,平衡不移动,水蒸气的转化率不变。
(3)增加CO的浓度,平衡向正反应方向移动。因为反应是体积减小的、吸热的可逆反应,所以降低压强或降低温度平衡都向逆反应方向移动。
本题难度:一般
5、简答题 某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)?2NH3(g);在2min时达到平衡状态,此时c(N2)=5.00mol?L-1,c(H2)=10.00mol?L-1,c(NH3)=5.00mol?L-1.试求:
(1)该温度下反应的平衡常数
(2)H2的起始浓度
(3)用N2表示该反应的平均反应速率
(4)N2的转化率.
参考答案:在2min时达到平衡状态时c(N2)=5.00mol?L-1,c(H2)=10.00mol?L-1,c(NH3)=5.00mol?L-1.
(1)平衡常数K=c2(NH3)c(N2)?c3(H2)=525×103=0.005,
答:该温度下反应的平衡常数为0.005.
(2)根据方程式可知,氢气的浓度变化量=5mol/L×32=7.5mol/L,故氢气的起始浓度=10mol/L+7.5mol/L=17.5mol/L,
答:氢气起始浓度为17.5mol/L.
(3)根据方程式可知,氮气的浓度变化量=5mol/L×12=2.5mol/L,故v(N2)=2.5mol/L2min=1.25mol/(L.min),
答:用N2表示该反应的平均反应速率为1.25mol/(L.min).
(4)氮气的起始浓度=5mol/L+2.5mol/L=7.5mol/L,故氮气转化率=2.5mol/L7.5mol/L×100%=33.3%,
答:氮气的转化率为33.3%.
本题解析:
本题难度:一般
|
 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?