1、填空题 (16分)在一个固定体积的密闭容器中发生某反应,当改变其他反应条件,在I、II、III阶段,体系中各物质浓度随时间变化的曲线如下图所示:
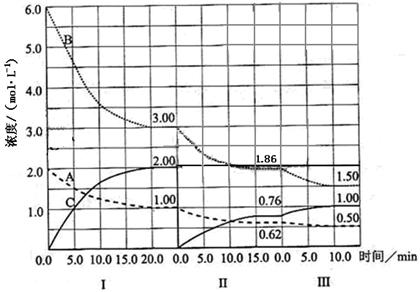
(1)该反应的化学方程式为 (物质用图中的“A”、“B”、“C”表示),该反应在第I阶段的平衡常数为 。
(2)第III阶段,从开始至平衡,用B表示的平均反应速率为 ;
(3)第I阶段,A的转化率为 ;第III阶段达平衡后,C的体积分数为 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),则该反应的正反应
△H 0(填“<”或“>”)
2、选择题 反应4A(g)+5B(g)?4C(g)+6D(g)△H=-Q?kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是( )
A.若增大压强,A和B的转化率都增大
B.若升高温度最终能生成更多的C和D
C.单位时间里有4n?mol?A消耗,同时有5n?mol?B生成
D.容器里A、B、C、D的浓度比是4:5:4:6
3、选择题 一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生反应:X(气)+Y(气)?mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ?2的关系为( )
A.φ1>φ2
B.φ1<φ2
C.φ1=φ2
D.无法判断
4、填空题 工业合成氨与制备硝酸一般可连续生产,流程如下
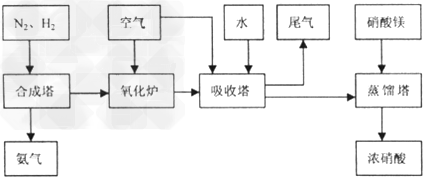
(1)工业生产时,制取氢气的一个反应为: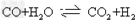 ,
,
①t℃时,往l?L密闭容器中充入0.2?mol?CO和0.3?mol水蒸气,反应建立平衡后,体系中c(H2)=0.12?mol/L,该温度下此反应的平衡常数K=________;(请填数字不必带单位)
②保持温度不变,向上述平衡体系中再加入0.1?mol?CO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=__________。
(2)合成塔中发生反应为:N2(g)+3H2(g) 2NH3(g)下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______573K(填“>”、“<”或“=”)。在生产中,若要增大H2的转化率,在其他条件不变的情况下可以采取的措施为________(填字母)。
2NH3(g)下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______573K(填“>”、“<”或“=”)。在生产中,若要增大H2的转化率,在其他条件不变的情况下可以采取的措施为________(填字母)。
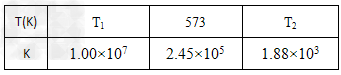
A.加入一定量H2?B.加入一定量N2?
C.将生成的气体NH3液化分离?D.升高温度
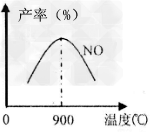
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2 4NO+6H2O?△H=-905kJ/mol,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因______________________。
4NO+6H2O?△H=-905kJ/mol,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因______________________。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___________________
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___________________
5、选择题 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时.M的体积分数y(M)与反应条件的关系如图所示.其中Z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
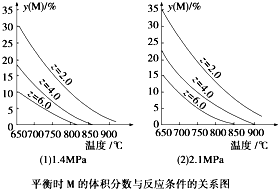
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加