1、选择题 某密闭容器中有可逆反应A(气)+2B(气) 3C(气)+D(气),能证明反应已达到平衡的事实是
3C(气)+D(气),能证明反应已达到平衡的事实是
A.容器内密度不随时间的变化而变化? B.容器内A、B、C、D浓度之比为2:2:3:1
C.A、D的消耗速率相等? D.D、C的生成速率保持1:3
参考答案:C
本题解析:略
本题难度:简单
2、填空题 反应N2+3H2 2NH3? ⊿H= —92.4 kJ/mol 在一定温度和体积不变的密闭容器中进行并达到平衡,如果最初c (N2 )= 2mol/L,c (H2)=5mol/L,反应达到平衡时有一半的N2发生了反应,则:
2NH3? ⊿H= —92.4 kJ/mol 在一定温度和体积不变的密闭容器中进行并达到平衡,如果最初c (N2 )= 2mol/L,c (H2)=5mol/L,反应达到平衡时有一半的N2发生了反应,则:
(1)求达到平衡时, H2和NH3的浓度分别为c (H2 )=?mol/L,c (NH3)="?" ?mol/L
(2)求平衡时H2的转化率为?;求平衡时NH3的物质的量与平衡后总物质的量的比值为?
(3)求该温度下的平衡常数为?;达到平衡后,提高温度,则平衡?(填正移,逆移或不移动);K值?;H2的转化率?(后两个空填增大,减小或不变)
参考答案:(1)c (H2 )=? 2?mol/L,c (NH3)= ?2?mol/L
(2)? 60%???0.4或2/5??
(3)? 0.5???逆移??
?减小 ??减小?
本题解析:略
本题难度:简单
3、计算题 恒温下,将amol N2和bmol H2的混合气体通入一固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g),
2NH3(g),
(1)若反应进行到某时刻t时刻,n(N2)=13mol,n(NH3)=6mol,计算a的值
(2)反应达到平衡时,混合气体的体积为716.8L(标况),其中NH3的含量为25%(体积分数),则平衡时n(NH3)=?
(3)原混合气体与平衡时混合气体的总物质的量之比n(始):n(平)=?
(4)原混合气体中,a:b=?
(5)达到平衡时,N2和H2的转化率之比为多少?
(6)平衡混合气体中,n(N2) :n(H2): n(NH3)=?
参考答案:(1)a=16mol
(2)n(NH3)=8mol
(3)5:4
(4)2:3
(5)1:2
(6)3:3:2
本题解析:
本题难度:一般
4、填空题 常温下,两种溶液① 0.1 mol?L-1 NH3·H2O?② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH ??7(填“>”、“<”或“=”),其原因是:?(用电离方程式表示)。
(2)溶液②呈?性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以?(填“促进”或“抑制”)NH4Cl的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是?(填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol?L-1
b.两种溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
参考答案:(1)>(1分)? NH3·H2O  ?NH4+ +OH- (2分)
?NH4+ +OH- (2分)
(2)酸(1分)?促进(1分)
(3)b (1分)
本题解析:
试题解析:(1)NH3·H2O是弱碱,其在水中部分电离产生NH4+、OH-,所以pH>7,
(2)NH4Cl溶液中的NH4+水解会使溶液呈酸性,pH<7,水解反应是吸热反应,升温使平衡向吸热反应方向进行,因此会促进NH4Cl的水解。
(3)a、NH3·H2O是弱碱,不完全电离;NH4Cl溶液中NH4+部分水解,所以两种溶液NH4+的浓度均小于0.1mol/l,错误;b、正确;c、两种溶液中NH4+的浓度的大小由电离程度和水解程度的强弱来判断,本题中无法判断,答案选b。
本题难度:简单
5、选择题 在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(气)+B(气) C(气)+D(气)
C(气)+D(气)
5 min后达到平衡。已知各物质的平衡浓度的关系为:
[A]a[B]=[C][D]</PGN0039A.TXT/PGN>
若在温度不变的情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为?
A.60%
B.40%
C.24%
D.4%
参考答案:B
本题解析:
容器体积扩大,但A转化率不变,可见反应前后总体积不变,因此a=1,方程式:
A(g)+ B(g)  ?C(g)+? D(g)
?C(g)+? D(g)
起始量? 2? 3? 0? 0
变化量? x? x? x? x
平衡量? 2-x? 3-x? x? x
平衡时? [A][B]=[C][D]
∴(2-x)(3-x)=x2
∴x=1.2
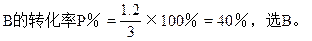
本题难度:一般