|
高考化学知识点整理《氯及其化合物》高频试题特训(2019年最新版)(四)
2020-07-28 04:31:17
【 大 中 小】
|
1、填空题 (15分)
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:

⑴请列举海水淡化的两种方法?、?。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式?.
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是:?.
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
?
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
?.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
A.H2
B.CO2
C.空气
D.O2 E.水蒸气
| ⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
?.
参考答案:

本题解析:略
本题难度:一般
2、选择题 自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生药品变质问题的是 (?)
A.AgNO3
B.FeCl2
C.Na2SO3
D.AlCl3
参考答案:D
本题解析:氯气溶于水生成氯化氢和次氯酸,所以A中生成氯化银沉淀,B中氯化亚铁被氧化生成氯化铁,C中亚硫酸钠被氧化生成硫酸钠,因此答案选D。
点评:该题是高考中的常见考点,属于中等难度的试题。试题难易适中,基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的朋友。该题的关键是明确氯水中的组成微粒,然后结合题意灵活运用即可。
本题难度:一般
3、填空题 (8分)①—⑩分别代表有关反应物中的一种物质,请完成下列各题:
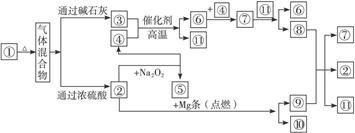
(1)①③④的化学式分别是__________________、___________________、_________________。
(2)⑧与⑨反应的化学方程式是
____________________________________________________。
参考答案:(1)NH4HCO3? NH3? O2
(2)C+4HNO3(浓)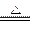 2H2O+4NO2↑+CO2↑ 2H2O+4NO2↑+CO2↑
本题解析:由各物质之间转化关系可知,分解产生混合气体的应为不稳定的盐,由反应条件可知气体混合物为二氧化碳、氨气、水蒸气混合物。因此①为NH4HCO3或(NH4)2CO3,②为CO2,③为NH3,④为O2,⑤为Na2CO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,11为H2O。
本题难度:简单
4、选择题 SO2和Cl2都具有漂白性,若将相同状况下等体积的这两种气体同时作用于潮湿的有色物质,可观察到的现象是(? )
A.立刻褪色
B.慢慢褪色
C.先褪色,后复原
D.颜色不褪
参考答案:D
本题解析:氯气具有强氧化性,SO2具有还原性,二者发生反应的方程式为Cl2+SO2+2H2O=H2SO4+2HCl,等体积混合后,失去漂白性,答案选D。
本题难度:一般
5、填空题 某学生利用以下装置探究纯净干燥的氯气与氨气之间的反应.
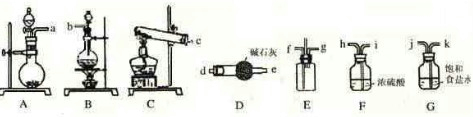
回答下列问题:
(1)根据下列所给试剂,选择制取氨气的装置是(填对应字母)______;写出制备氯气的离子反应方程式______.
二氧化锰、碱石灰、浓盐酸、浓氨水、烧碱、生石灰
(2)已知,E装置是用于使纯净干燥的氯气与氨气发生反应的装置,试说明该装置的设计意图:______.
(3)根据实验目的,所选装置的连接顺序为(填装置的接口字母):______接______,______接(?f?),(?g?)接______,______接______,______接______;其中,G装置的作用是______.
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,该反应的化学方程式为:______;其中,氧化剂与还原剂的物质的量之比是______.
(5)请你评价此套装置有何缺点______.
参考答案:(1)根据提供的药品,应用浓氨水和碱石灰或生石灰反应制备氨气,可用A装置,实验室用二氧化锰和浓盐酸反应制备氯气,反应的离子方程式
为MnO2+4H++2C1-?△?.?Mn2++C12↑+2H2O,故答案为:A;?MnO2+4H++2C1-?△?.?Mn2++C12↑+2H2O;
(2)由于氨气的密度小,氯气的密度大,密度小氨气的从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快的充分的混合,具体操作为将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力,
故答案为:将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力;
(3)装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),B装置中盛放的碱石灰,用来干燥氨气;G装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;F装置用来干燥氯气,然后在E中混合反应,则连接顺序为a接d,e接f,g接h,i接j,k接b,
故答案为:a;d;e;h;i;j;k;b;除去C12中的HCl气体;
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,反应的化学方程式为3C12+8NH3=6NH4Cl+N2,由化合价的变化可以看出,当3mol氯气参加反应时,有2mol氨气被氧化,所以氧化剂和还原剂的物质的量之比为3:2,
故答案为:3C12+8NH3=6NH4Cl+N2;3:2;
(5)氯气和氨气都污染空气,不能直接排放到空气中,实验缺少尾气处理装置,
故答案为:缺少尾气处理装置,造成空气污染.
本题解析:
本题难度:一般
|