1、选择题 浓度为0.01mol·L-1的HCl溶液V mL,加水稀释到2V mL,取出10mL,这10mL溶液中含有H+物质的量浓度(单位:mol·L-1)为?
A.0.005
B.0.001
C.0.002
D.0.05
参考答案:A
本题解析:浓度为0.01mol·L-1的HCl溶液V mL,加水稀释到2V mL后,H+物质的量浓度为0.005mol·L-1,取出10mL,溶液浓度不变,所以,H+物质的量浓度仍为0.005mol·L-1,选A。
本题难度:一般
2、选择题 在标准状况下,与22.4LH2体积相等的N2的( )
A.质量为14g
B.质量为7g
C.物质的量为1mol
D.物质的量为2mol
参考答案:标准状况下,与22.4LH2体积相等的N2,其物质的量相等,均为22.4L22.4L/mol=1mol,
A.氮气的质量为1mol×28g/mol=28g,故A错误;
B.氮气的质量为1mol×28g/mol=28g,故B错误;
C.由上述分析可知,物质的量为1mol,故C正确;
D.由上述分析可知,物质的量为1mol,故D错误;
故选C.
本题解析:
本题难度:简单
3、计算题 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58克白色沉淀,在所得的浊液中逐渐加入0.5mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如下图所示 。
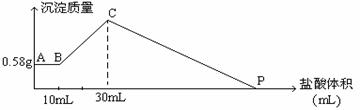
回答下列问题:
①混合物中NaOH质量为 ; ②混合物中AlCl3的物质的量为 ;
③混合物中MgCl2的物质的量为 ;④P点所示的盐酸体积为 。
参考答案:①2.6g; ②0.01mol;③ 0.01mol;④ 130ml
本题解析:同图像可知当加入10mL盐酸时,沉淀质量不变化,发生反应为OH-+H+=H2O。说明氢氧化钠、氯化铝、氯化镁溶于水生成氢氧化镁沉淀、NaAlO2,同时氢氧化钠过量。当再加入20mL时,产生沉淀至质量最大,继续加入盐酸,氢氧化镁和氢氧化铝溶解。(1)中和过量OH-需要10mL盐酸,所以过量NaOH0.005mol;生成0.58gMg(OH)2需要NaOH0.02mol;20mL盐酸与AlO2-恰好生成Al(OH)3沉淀,所以n(AlO2-)=0.01mol,原混合物中AlCl3物质的量为0.01mol,Al3+生成AlO2-需要NaOH0.04mol,所以原固体中NaOH物质的量为0.065mol。由镁元素守恒知原混合物中氯化镁为0.01mol。溶解0.01molMg(OH)2和0.01molAl(OH)3共需要盐酸0.05mol,体积为100mL,所以P点为130mL。
考点: 化学计算
点评:本题关键是起始时向浊液中加入10mL盐酸时沉淀质量不变,说明氯化镁、氯化铝、氢氧化钠固体溶于水时氢氧化钠过量,10mL盐酸中和过量氢氧化钠。
本题难度:一般
4、填空题 [第(1)(3)(4)(6)问每空1分;(2)(5)每空2分,共13分]
粗食盐中常含有少量Ca2+、Mg2+、SO42-以及泥沙等杂质,实验室提纯NaCl的流程如下(加入的试剂稍过量)

(1)步骤③中加入的试剂A是 (填化学式),其目的是 。
(2)第⑥步中,写出相应的离子方程式 。
(3)步骤⑤和⑥之间,若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是 。
(4)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,其中过滤时,使用玻璃棒的目的是 。
(5)用上述方法获得的氯化钠去配制200mL0.1mol/LNaCl溶液。
①用托盘天平称氯化钠固体的质量是 g
②配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
③下列操作中,可能造成所配制溶液的浓度偏低的是 。
A.没有洗涤烧杯和玻璃棒
B.定容时,仰视刻度线读数
C.定容时,俯视刻度线读数
D.洗涤后的容量瓶中残留少量蒸馏水