|
高考化学试题《离子共存》高频试题巩固(2019年最新版)(六)
2020-07-28 04:37:07
【 大 中 小】
|
1、选择题 下列离子在溶液中可以大量共存的一组是
A.H+、Na+、OH-
B.Na+、NO3-、Cl-
C.K+、H+、HCO3-
D.Ca2+、SO42-、CO32-
|
参考答案:B
本题解析:A H+、OH-不能共存
B 能大量共存
C H+、HCO3-不能共存
D Ca2+、CO32-不能共存
本题难度:一般
2、选择题 在pH=1的无色溶液中,下列各离子组因发生氧化还原反应而不能共存的是
A.NH4+ K+ Na+ CO32- NO3-
B.K+ Na+ Fe2+ SO42- NO3-
C.NH4+ K+ Na+ HCO3-[Al(OH)4]-
D.NH4+ K+ Na+ NO3- I-
参考答案:D
本题解析:根据无色溶液,B项中Fe2+有颜色,不符合题意;A、C不能共存但不发生氧化还原反应,不符合题意;D项中NO3?、H+氧化I?,不能共存,符合题意。
本题难度:一般
3、选择题 在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、CO32-、Ca2+、NO3-
B.Na+、NO3-、Al3+、Cl-
C.K+、SO42-、Cl-、Cu2+
D.Ba2+、Cl-、K+、SO42-
参考答案:A.酸溶液中不能大量存在CO32-,且CO32-、Ca2+结合生成沉淀,不能大量共存,故A错误;
B.酸性溶液中该组离子之间不反应,能大量共存,故B正确;
C.该组离子之间不反应,但Cu2+为蓝色,与无色溶液不符,故C错误;
D.因SO42-、Ba2+结合生成沉淀,不能大量共存,故D错误;
故选B.
本题解析:
本题难度:一般
4、填空题 (15分)云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
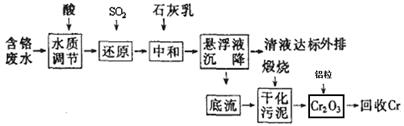
(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是: ?。 ?。
(2)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式k=?,若继续加水稀释,平衡将?移动(填“正向”、“逆向”“不”)。 2CrO42-+2H+,请写出该平衡的平衡常数表达式k=?,若继续加水稀释,平衡将?移动(填“正向”、“逆向”“不”)。
(3)请写出通入SO2时发生的离子反应:?。
(4)写出加入铝粒时发生反应的化学方程式?,该反应是焓?(填“增加”或“减少”)反应。
II.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成份。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其它成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(5)铬渣烧结炼铁法中煤粉的作用是?。(写两点)
(6)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2—+□H2O=□Cr(OH)3+□S2O32—+□OH—
参考答案:(1)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。(2分)
(2)c(CrO42-)2c(H+)2/c(Cr2O72-)(2分)?正向(2分)
(3)Cr2O72-+3SO2+2H+=2Cr3++3SO42-+ H2O(2分)
(4)2Al+Cr2O3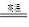 Al2O3+2Cr(2分)?焓减少(1分) Al2O3+2Cr(2分)?焓减少(1分)
(5)为高炉冶炼过程提供热源;燃烧后生成的CO是高炉冶炼过程的还原剂;还起到高温填料的作用(写两点即可)(2分)
(6)4? 6? 19? 8? 3? 14?(2分)
本题解析:(1)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据。
(2)水为纯液体,浓度为常数,在平衡常数表达式中不出现;加水稀释,使c(Cr2O72-)、c(CrO42-)、c(H+)均减少,该反应的浓度商公式中,分子减少的更快,使浓度商<平衡常数,平衡正向移动。
(3)根据流程图分析Cr2O72-转化为Cr3+,SO2一般是转化为SO42-,根据化合价升降法配平方程式。
(4)铝热反应是放热反应,即焓减少反应。
(6)根据化合价升降法配平方程式。
本题难度:困难
5、选择题 要使Ba2+、Al3+、Cu2+、Mg2+、Ag+五种离子从混合液中逐一沉淀析出,下列选用的试剂和加入的顺序正确的是
A.HCl→H2SO4→H2S→NaOH→CO2
B.NaCl→Na2SO4→NaOH→H2S→CO2
C.Na2S→Na2SO4→NaCl→NaOH→CO2
D.Na2SO4→HCl→H2S→NaOH→CO2
参考答案:A
本题解析:
正确答案:A
各阴离子沉淀的阳离子分别是,Cl― : Ag+;? SO42―: Ba2+、Ag+;? S2―: Cu2+、Ag+; OH― :Al3+、Cu2+、Mg2+、Ag+。综上分析,应先将Ag+沉淀,再将Ba2+沉淀,然后沉淀Cu2+,最后再加过量的碱,沉淀M2+,同时将Al3+转化为AlO2―,再能CO2生成Al(OH)3沉淀。A答案正确。
本题难度:简单
|