1、选择题 根据以下实验的检验所得出的结论可靠的是
A.常温下测得等物质的量浓度碳酸的pH大于盐酸的pH,所以碳元素比氯元素的非金属性弱
B.向无色溶液通入Cl2?后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明原溶液中有I-
C.向溴苯中加入稀氢氧化钠并加热,冷却后取出少量溶液于小试管中,加入稀AgNO3溶液,未发现有浅黄色沉淀生成,由此确定溴苯还未水解
D.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀盐酸,沉淀不消失,由此确定该溶液中一定含有SO42-
参考答案:B
本题解析:分析:A.利用最高价氧化物水化物的酸性比较非金属性;
B.碘单质遇淀粉变蓝;
C.检验溴离子应在酸性条件下;
D.AgCl也不溶于水不溶于酸.
解答:A.利用最高价氧化物水化物的酸性比较非金属性,盐酸为无氧酸,则不能利用酸性比较非金属性,故A错误;
B.碘单质遇淀粉变蓝,则向无色溶液通入Cl2?后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明原溶液中有I-,故B正确;
C.向溴苯中加入稀氢氧化钠并加热,冷却后取出少量溶液于小试管中,加硝酸至酸性,再加入稀AgNO3溶液检验溴离子,故C错误;
D.AgCl也不溶于水不溶于酸,则向无色溶液加BaCl2溶液,生成白色沉淀,再加稀盐酸,沉淀不消失,由此确定该溶液中可能含有SO42-,还可能为Ag+,故D错误;
故选B.
点评:本题考查物质的检验及鉴别,侧重物质性质的考查,涉及非金属性的比较、离子的检验、水解等,注重基础知识的考查,选项C为解答的易错点,题目难度不大.
本题难度:困难
2、选择题 下列物质含有离子键的是
A.C2
B.NaCl
C.CO2
D.H2O
参考答案:B
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,所以选项B正确。其余都是含有共价键的,答案选B。
本题难度:一般
3、选择题 下列气态氢化物按稳定性由强到弱顺序的是
A.HBr、HCl、HF
B.HF、H2O、NH3
C.NH3、PH3、H2S
D.SiH4、CH4、NH3
参考答案:B
本题解析:试题分析:原子半径越大气态氢化物的稳定性越差,非金属性越强,气态氢化物稳定性越强。
A项中同主族元素从上到下,原子半径逐渐增大,氢化物的稳定性逐渐减弱,故A不符合。
B项中同周期元素从左到右,原子半径逐渐减小,氢化物的稳定性逐渐增强,故B正确。
C项中稳定性强弱顺序应为:NH3> H2S >PH3?,故C不符合。
D项中稳定性强弱顺序应为:NH3> CH4 > SiH4 ,故D不符合。
考点:元素周期律
点评:本题考查元素性质的递变规律,依据元素周期律,可用排除法解答,题目难度不大。
本题难度:简单
4、选择题 第28届国际地质大会提供的资料显示,在海底蕴藏着大量的天然气水合物,俗称“可燃冰”(CH4·nH2O)。其蕴藏量是地球上煤和石油的几百倍,因而是一种等待开发的巨大能源物质。下列有关可燃冰的预测中错误的是。
A.高压、低温有助于可燃冰的形成
B.可燃冰的主要成分是甲烷
C.可燃冰的微粒间可能存在着离子键
D.构成可燃冰的原子间存在着极性共价键
参考答案:C
本题解析:根据可燃冰存在于海底深处可知,选项A正确;可燃冰的主要成分是甲烷,B正确;碳、氢、氧都是非金属性元素,在可燃冰中不可能存在离子键,C不正确;碳、氢、氧都是不同非金属性元素,所以构成可燃冰的原子间存在着极性共价键,D正确,答案选C。
考点:考查可燃冰的有关判断
点评:在判断化学键类型时,一般遵循的原则是:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,据此可以判断。
本题难度:简单
5、选择题 下列过程,不需要破坏化学键的是
A.钠与水反应
B.干冰升华
C.碳酸氢钠受热分解
D.HCl气体溶于水
参考答案:B
本题解析:化学反应一定有化学键的断裂,Na与H2O反应,破坏了H2O中的H—O键。NaHCO3受热分解,破坏了Na+与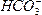 的离子键和H—O键。HCl气体溶于水破坏了H—Cl键。干冰升华只是由固体变成气体,CO2分子本身并未变化。
的离子键和H—O键。HCl气体溶于水破坏了H—Cl键。干冰升华只是由固体变成气体,CO2分子本身并未变化。
本题难度:简单