1、填空题 向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应
PCl5(g)  PCl3(g)+C12(g)?
PCl3(g)+C12(g)?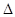 H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:
时间t/s
| 0
| 50
| 150
| 250
| 350
|
n(PCL3)/mol
| 0
| 0.16
| 0.19
| 0.2
| 0.2
|
?
回答下列问题
(1)反应在前50 s的平均速率v(PCI5)=________。
(2)温度为T时,该反应的化学平衡常数=________。
(3)要提高上述反应的转化率,可采取的措施有________。
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=________。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4),该反应的化学方程式是________。
若将0.01 mol PCI5投入l L热水中,再逐滴加入AgNO3溶液,先产生的沉淀是________ [已知Ksp(Ag3 PO4)="1.4" x 1 0-16,Ksp(AgCl)="1.8" x 10-10]。
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,该气体与白磷的物质的量之比为20:3,反应的化学方程式为____________________________。
参考答案:
(1)0.0016 mol/( L·s) (2)0.025
(3)升高温度(或降低压强或移走PCl3、Cl2等合理答案)
(4)0.1?(5)PCl5+4H2O = H3PO4+5HCl?AgCl
(6)3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO↑
本题解析:(1)反应在前50 s的平均速率v(PCI3)=Δc/Δt=0.16mol÷2.0L÷50s=0.0016mol/(L·s).由于v(PCI5)= v(PCI3)= 0.0016 mol/( L·s).由表中数据可以看出,在温度为T,当反应达到平衡时,n(PCI3)=" 0.2mol" ,n(C12)=0.2mol.,n(PCI5)=0.8mol.所以c(PCI5)=0.4mol/L;c(PCI3)=0.1mol/L;c(C12)=0.1mol/L,所以化学平衡常数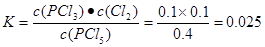 .(3)由于该反应的正反应为气体体积增大的吸热反应,所以要提高上述反应的转化率,可采取的措施有减小压强,或升高温度或从平衡混合物中分离出PCl3、Cl2等措施。(4)由于起始时向容器中充入0.5mol PCl5和a mol Cl2,而且平衡时PCl5的转化率仍为20%,则达到平衡时n(PCl5)=0.4mol;n(PCl3)=0.1mol;n(Cl2)= (0.1+a)molc(PCl5)=" 0.2mol/L," c(PCl3) =0.05mol/Lc(Cl2)="(0.1+a)/2L"
.(3)由于该反应的正反应为气体体积增大的吸热反应,所以要提高上述反应的转化率,可采取的措施有减小压强,或升高温度或从平衡混合物中分离出PCl3、Cl2等措施。(4)由于起始时向容器中充入0.5mol PCl5和a mol Cl2,而且平衡时PCl5的转化率仍为20%,则达到平衡时n(PCl5)=0.4mol;n(PCl3)=0.1mol;n(Cl2)= (0.1+a)molc(PCl5)=" 0.2mol/L," c(PCl3) =0.05mol/Lc(Cl2)="(0.1+a)/2L" 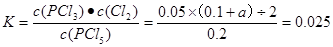 .解得a=0.1mol。(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4)的化学方程式是PCl5+4H2O = H3PO4+5HCl。若将0.01 mol PCI5投入l L热水中则产生的Cl-的浓度为c(Cl-)=0.05mol/L,而H3PO4是弱电解质,c(PO43-) <<0.01mol/L. 所以再逐滴加入AgNO3溶液首先要产生AgCl沉淀。(6)根据题意可得方程式为:3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO↑
.解得a=0.1mol。(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4)的化学方程式是PCl5+4H2O = H3PO4+5HCl。若将0.01 mol PCI5投入l L热水中则产生的Cl-的浓度为c(Cl-)=0.05mol/L,而H3PO4是弱电解质,c(PO43-) <<0.01mol/L. 所以再逐滴加入AgNO3溶液首先要产生AgCl沉淀。(6)根据题意可得方程式为:3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO↑
本题难度:一般
2、选择题 可逆反应2SO2(g)+O2(g)
参考答案:
本题解析:
本题难度:一般
3、填空题 (5分)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。这段反应速率最快的原因是 。

(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸