1、选择题 关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是
A.KCl中含有35Cl
B.生成物Cl2的相对分子质量为73.3
C.该反应转移的电子数为6e-
D.氧化剂和还原剂的物质的量之比为1:6
参考答案:B
本题解析:B选项中相对原子质量在数值上与质量数是约等于的,所以B选项是错误的。
本题难度:一般
2、简答题 向20mLAlCl3溶液中滴入2mol/LNaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中A点表示的意义是______.
(2)图中B点表示的意义是______.
(3)若溶液中有Al(OH)3沉淀0.39g,此时用去NaOH溶液体积为______.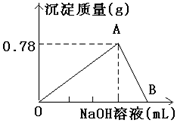
参考答案:(1)由图象可知,0~A发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,故答案为:Al3+完全沉淀;
(2)由图象可知A~B发生Al(OH)3+NaOH═NaAlO2+2H2O,则B点时Al(OH)3刚好完全溶解,故答案为:Al(OH)3刚好完全溶解;
(3)溶液中有Al(OH)3沉淀0.39g,n=0.39g78g/mol=0.005mol,存在两种情况,则
①只发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,设此时用去NaOH溶液体积为x,则
0.005mol×32mol/L=0.0075L=7.5mL,
②若发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,则
0.01mol×3+0.005mol2mol/L=0.0175L=17.5mL,
故答案为:7.5mL或17.5mL.
本题解析:
本题难度:一般
3、填空题 (8分)按要求回答下列问题
①写出Ba(OH)2溶于水时的电离方程式:?
②写出工业生产氯气的化学方程式:?
③写出Mg在CO2气体中点燃的化学方程式:?
④写出钠和水反应的离子方程式:?
参考答案:①Ba(OH)2=Ba2++2OH-? ②2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
③2Mg+3CO2 2MgCO3+C? ④2Na+2H2O=2Na++2OH-+H2↑
2MgCO3+C? ④2Na+2H2O=2Na++2OH-+H2↑
本题解析:①Ba(OH)2强电解质,在水中完全电离,其电离方程式为:Ba(OH)2=Ba2++2OH-
②工业用电解饱和食盐水生产氯气,其方程式为:2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
③Mg在CO2中燃烧生成C和MgO,其方程式为:2Mg+3CO2 2MgCO3+C
2MgCO3+C
④Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑
点评:本题非常基础简单。
本题难度:一般
4、选择题 下列化学用语表达不正确的是
A.Na+的结构示意图: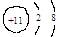

B.水分子的电子式: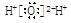
C.二氧化碳的结构式:O="C=O"
D.碳酸氢钠的电离方程式:NaHCO3= Na+ + HCO3ˉ
参考答案:B
本题解析:略
本题难度:一般
5、选择题 下列实验现象与氧化还原反应有关的是
A.将点燃的镁条伸入充满二氧化碳的集气瓶中,观察到有白色固体生成,瓶壁上有黑色固体颗粒附着
B.“水玻璃”与空气中的二氧化碳接触,生成了乳白色的凝胶状沉淀
C.取少量溴水于试管中,再加入CCl4,振荡,静置后观察到液体分层,下层呈红棕色
D.用一定量的硫酸溶液进行导电性实验,发现灯泡较亮。向其中逐滴加入氢氧化钡溶液,发现灯泡亮度先逐渐变暗,后又逐渐变亮
参考答案:A
本题解析:A中在加热的条件下,镁和CO2发生置换反应生成氧化镁和碳,属于氧化还原反应;B中是硅酸钠吸收CO2,生成硅酸沉淀,属于复分解反应;C中是萃取,是物理变化;D中导电性实验,稀硫酸和氢氧化钡的反应是中和反应,不是氧化还原反应,答案选A。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题基础性强,主要是考查学生对氧化还原反应有关知识的熟悉了解程度,有利于培养学生的逻辑推理能力。该题的关键是熟练记住常见物质之间的转化,然后灵活运用即可。
本题难度:一般