1、选择题 下列各组元素性质的递变错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Be、Mg、Ca、Sr、Ba的失电子能力依次增强
参考答案:A、Li、Be、B三种元素原子位于第二周期,电子层数相同,最外层电子数依次增多,故A正确;
B、P、S、Cl三种元素位于第三周期,最高化合价分别为+5、+6、+7,化合价升高,故B正确;
C、同周期从左到右原子半径依次减小,B、C、N、O、F原子半径应依次减小,故C错误;
D、Be、Mg、Ca、Sr、Ba元素位于第ⅡA主族,从上到下失电子能力依次增强,故D正确;
故选C.
本题解析:
本题难度:简单
2、推断题 A~F六种元素中,除A外均为短周期元素,它们的原子结构或性质如下表所示

|
(1)E元素在元素周期表中的位置为______。
(2)B与D形成化合物的电子式是________。
(3)CO2能与上述某些元素形成的物质发生置换反应,该反应化学方程式是____________________。
(4)F的单质与A、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是____________。
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量(装置中因空气质量引起的误差忽略不计)。
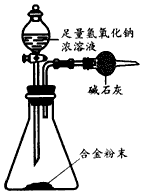
①实验需要测定三个物理量:合金的质量m以及a和b;a是________;b是________。
②合金中A元素的质量分数是___________(用含m、a、b的式子表示)。
参考答案:(1)第三周期第ⅥA族
(2)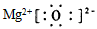
(3)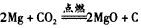
(4)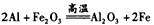
(5)①反应前装置和药品的总质量;反应后装置和药品的总质量;②
本题解析:
本题难度:一般
3、选择题 对第三周期元素Na、Mg、Al的有关性质的叙述正确的是( )
A.电负性:Na>Mg>Al
B.第一电离能:Na<Mg<Al
C.还原性:Na>Mg>Al
D.碱性:NaOH<Mg(OH)2<Al(OH)3
参考答案:A.同周期元素从左到右,元素的电负性逐渐增强,则电负性:Na<Mg<Al,故A错误;
B.同周期元素从左到右,第一电离能逐渐增大,但Mg的最外层为全充满状态,电子能量最低,第一电离能Mg>Al,故B错误;
C.同周期元素从左到右,元素的金属性逐渐减弱,对应单质的还原性逐渐减弱,故C正确;
D.同周期元素从左到右,元素的金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故D错误.
故选C.
本题解析:
本题难度:一般
4、推断题 A,B,C,D,E,F为原子序数依次增大的短周期主族元素。已知:A,C,F 3种元素原子的最外层共有11个电子,且这3种元素的最高价氧化物对应水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A____,D____, E____。
(2)B单质在F单质中的燃烧现象是________________,用电子式表示反应的过程是_________________
化学反应方程式是____________________。
(3)A,C两种元素最高价氧化物对应水化物反应的离子方程式是________________________。
参考答案:(l)Na;Si;P
(2)产生白色的烟; ;Mg+Cl2
;Mg+Cl2 MgCl2
MgCl2
(3)OH-+Al(OH)3=AlO2-+2H2O
本题解析:
本题难度:一般
5、选择题 下列有关各项比较中错误的是
A.热稳定性PH3>H2S>HCl>NH3
B.物质的熔点石英>食盐>白磷>水银
C.结合质子的能力HCO3->CH3COO->Br-
D.分散系中分散质粒子的直径Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
参考答案:A
本题解析:
本题难度:一般