1、推断题 (10分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
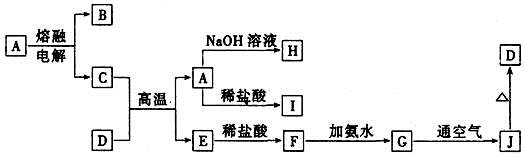
请回答下列问题:做无机推断题找到突破点是关键,A是一种高熔点物质,可知A为Al2O3,D是一种红棕色固体,可知D为Fe2O3,B为O2,C为Al,E为Fe,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,H为NaAlO2,I为AlCl3。
(1)电解A物质的阳极电极反应式为___________,C与D在高温下反应,引发该反应需要加入的一种试剂是____________________(写化学式)
(2)写出G→J反应的实验现象与化学方程式____________________________________,__________________________________
(3)H 与I反应的离子方程式为___________________________________________
(4)用离子方程式表示I物质能用于净水的原理___________________________________
参考答案:(1)2O2——4e—=O2? KClO3(各1分)
(2)生成的白色沉淀迅速变为灰绿色最终变为红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Al3++3AlO2—+6H2O=4Al(OH)3↓(4)Al3++ 3H2O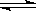 Al(OH)3(胶体)+ 3H+
Al(OH)3(胶体)+ 3H+
本题解析:做无机推断题找到突破点是关键,A是一种高熔点物质,可知A为Al2O3,D是一种红棕色固体,可知D为Fe2O3,B为O2,C为Al,E为Fe,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,H为NaAlO2,I为AlCl3。
(1)阳极失去电子,电极反应式为2O2——4e—=O2。Al和Fe2O3反应需要引燃剂KClO3。
(2)Fe(OH)2→Fe(OH)3中发生的实验现象教材中很详细且常考的知识点,生成的白色沉淀迅速变为灰绿色最终变为红褐色,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)NaAlO2与AlCl3反应是双水解反应,离子方程式为:Al3++3AlO2—+6H2O=4Al(OH)3↓。
(4)AlCl3水解的原理是Al3+发生水解生成Al(OH)3(胶体)具有吸附能力,离子方程式为:Al3++ 3H2O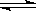 Al(OH)3(胶体)+ 3H+。
Al(OH)3(胶体)+ 3H+。
点评:本题考查了物质转化关系的应用,物质性质的应用,主要是铁及其化合物性质铝及其化合物性质的综合应用,关键是反应现象和反应条件的应用判断,特征反应的分析判断。
本题难度:困难
2、推断题 图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
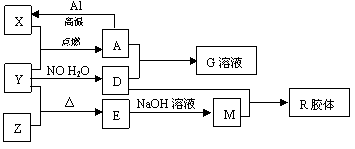
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是__________;M中存在的化学键类型为__________;R的化学式是__________。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为__________。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:__________________________。
(4)写出A和D的稀溶液反应生成G的离子方程式:____________________。
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出
n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。

参考答案:(1)第二周期第ⅥA族;离子键、共价键;H2SiO3(H4SiO4)(2)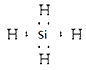 (3)8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s) △H=-8aKJ/mol
(3)8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s) △H=-8aKJ/mol
(4)3Fe3O4+28H++NO3-=9Fe3++14H2O+NO↑?(5)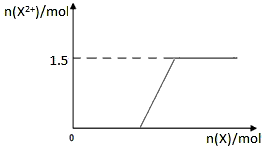
本题解析:
本题难度:一般
3、推断题 A、B、C为三种重要的工业原料,焰色反应均为黄色,其中A常用来制糕点,B可用来去除油污,他们之间的转化关系如下
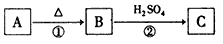
请回答:
(1)反应①的化学方程式是__________________。
(2)B的水溶液中c(H+)______c(OH-)(填“>”或“<”),原因是____________(用离子方程式表示) 。
(3)在B的水溶液中滴加BaCl2溶液后有白色沉淀生成。将所得沉淀分成两份,一份中滴加过量HNO3,现象是__________________,反应的离子方程式是__________________;另一份中先加入过量C的溶液后,充分振荡,过滤后在滤渣中再滴加过量的HNO3,滤渣不溶解,反应的离子方程式是____________。
参考答案:(1)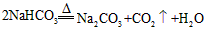
(2)<;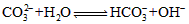
(3)白色沉淀溶解,有气泡产生;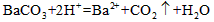 ;
;
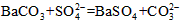
本题解析:
本题难度:一般
4、填空题 W、X、Y、Z为原子序数依次增大的四种短周期主族元素.其中W的一种原子核内没有中子,Y的原子最外层电子数是其内层电子数的3倍.Y与Z能形成两种常见的离子化合物Z2Y和Z2Y2.X与Y能形成两种化合物,其相对分子质量之比为7:11.请回答:
(1)Z在元素周期表中的位置是______.
(2)X、Z两元素原子的次外层电子数之比为______.
(3)用电子式表示化合物W2Y的形成过程______.
(4)由W与X两种元素组成的中学化学常见化合物甲,其相对分子质量为78.甲不可能发生的反应有______(填序号).
①与氢气反应;?②与氧气反应;③与液溴反应;?④与酸性高锰酸钾溶液反应
(5)由W、X、Y三种元素组成的有机物乙,相对分子质量为60.由W、X、Y、Z四种元素组成的无机物丙,相对分子质量为84,受热易分解.又知乙与丙反应能放出气体,写出乙溶液与丙溶液反应的离子方程式:______.
参考答案:W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W的一种原子核内没有中子,则W应为H元素,
Y的原子最外层电子数是其内层电子数的3倍,核外各电子层电子数分别为2、6,应为O元素,
Y与Z能形成两种常见的离子化合物Z2Y和Z2Y2,则Z为Na元素,形成的化合物分别为Na2O和Na2O2,
X与Y能形成两种化合物,其相对分子质量之比为7:11,相对分子质量分别为28、44,应为CO和CO2,X为C元素,
(1)Z为Na元素,原子序数为11,原子核外有3个电子层,最外层电子数为1,则应在周期表第三周期ⅠA族,故答案为:第三周期ⅠA族;
(2)X、Z分别为C、Na,核外次外层电子数分别为2、8,则两元素原子的次外层电子数之比为2:8=1:4,故答案为:1:4;
(3)W2Y为H2O,属于共价化合物,用电子式表示的形成过程为
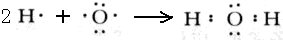
,
故答案为:
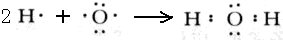
;
(4)由W与X两种元素组成的中学化学常见化合物甲,其相对分子质量为78,应为苯,性质稳定,不能与酸性高锰酸钾溶液反应,在催化剂条件下易发生取代反应,易燃烧,能加成,故答案为:④;
(5)由W、X、Y三种元素组成的有机物乙,相对分子质量为60,应为CH3COOH,为弱酸,由W、X、Y、Z四种元素组成的无机物丙,相对分子质量为84,受热易分解,则丙为NaHCO3,
二者反应的离子方程式为CH3COOH+HCO3-═CH3COO-+CO2↑+H2O,
故答案为:CH3COOH+HCO3-═CH3COO-+CO2↑+H2O.
本题解析:
本题难度:一般
5、填空题 有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成H2和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式A??B??C??
(2)写化学方程式①A在空气中燃烧?
②C与水蒸气反应?
③A与水反应?
参考答案:(1)A? Na??B? Mg??C? Fe??
(2)①? ?
?
②?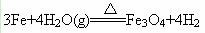 ?
?
③? 2Na+2H2O===2NaOH+H2↑?
本题解析:略
本题难度:简单