1、填空题 已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁。电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是?,证明Fe3+存在的现象是?。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式(1分):?
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
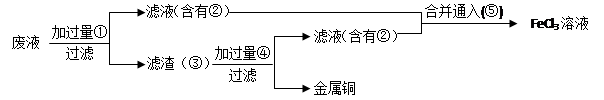
A.请写出上述实验中加入或生成的有关物质的化学式:
①?,②?,④?,
B.请写出含有②的滤液与⑤反应的离子方程式(1分):?
该反应中氧化剂为?还原剂为?。
参考答案:(9分)(1)KSCN;溶液呈红色 ;(2) 2Fe3++Cu=2Fe2++Cu2+
(3) A.①Fe ,②FeCl2,④HCl? B. 2Fe2+ + Cl2 ="=" 2Fe3+ + 2Cl-;Cl2;FeCl2
本题解析:(1)铁离子能和KSCN溶液发生显色反应,溶液显红色,所以检验溶液中Fe3+存在的试剂是能和KSCN溶液。
(2)氯化铁能和氧化金属铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+。
(3)要从废液中回收金属铜,则需要加入还原剂铁粉,即①是Fe。过滤后生成的滤液是氯化亚铁,即②是氯化亚铁。而滤渣中含有铜和剩余的铁,则需要加入稀盐酸溶解铁,即④是HCl。滤液中含有氯化亚铁,要转化为氯化铁,则需要通入氯气将氯化亚铁氧化生成氯化铁即可。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,注重能力的培养。该类试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
2、选择题 下列说法正确的是( )
A.工业上用C还原Al2O3产生Al
B.氯水能使红色花瓣褪色
C.常温下,硅与浓HNO3反应放出NO2
D.Fe(OH)2溶于NaOH溶液
参考答案:B
本题解析:
本题难度:一般
3、选择题 11.6gFe3O4加到100mL某浓度的盐酸中,再加入9.8g铁粉,反应停止时,溶液中无固体存在。立即往溶液中通入氮气,同时滴加5.0mol/LNaOH溶液到溶液中,金属离子刚好生成白色沉淀,共消耗NaOH溶液160mL。则原盐酸的物质的量浓度为
A.2mol/L
B.4 mol/L
C.6 mol/L
D.8mol/L
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (1)现有浓度各为1?mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:
①充分反应后铁粉有剩余,则溶液中一定含有__________阳离子,一定没有__________阳离子。有关反应的离子方程式是___________________。
②充分反应后铁粉无剩余,有铜生成。则反应后的溶液中一定含有_________阳离子;溶液中可能含有_________阳离子,该阳离子在溶液中物质的量的可能存在范围是:?______________________。
③充分反应后,无固体沉淀物存在,反应后的溶液中一定含有____和____阳离子。
(2)现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为0.1?mol。在此溶液中加入90?mL?4?mol?/?L的NaOH溶液,使其充分反应;设Al3+的物质的量与总物质的量的比值为x。?
①根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是___________;物质的量是__________mol。
②计算沉淀中只有Fe(OH)3时的x的取值范围___________。
参考答案:(1)①Fe2+;Fe3+、Cu2+;2Fe3+ +Fe =3Fe2+、Cu2+ + Fe =Fe2+ +Cu
②Fe2+ ;Cu2+;0≦n(Cu2+)<0.1mol
③ Fe2+ ;Cu2+
(2)①Fe(OH)3;0.06mol;②0≦X≦0.6
本题解析:
本题难度:一般
5、选择题 某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属不溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
参考答案:D
本题解析:A不正确,溶液中含有NO3-,加入硫酸,可以继续氧化金属。B不一定正确,也可能是亚铁离子。336mlNO是0.015mol,所以0.05b>0.015mol,C不正确。合金中铁和铜的物质的量分别是ymol-aymol、aymol,失去电子是3ymol-3aymol+2aymol=3ymol-aymol。则被还原的硝酸是ymol-ay/3mol。所以一定有0.05b≥y-ay/3+3y-3ay+2ay,解得b≥80 y (1—a/3),答案选D。
本题难度:一般