1、选择题 下列实验事实中不能说明NH3·H2O是弱电解质的是(?)
A.氨水溶液中只有少量OH—
B.常温下0.1mol/L氨水溶液pH=11
C.NH4Cl溶液显酸性
D.NH3·H2O只能部分电离产生NH4+和OH—
参考答案:A
本题解析:弱电解质只有部分发生电离,故BD正确,有弱才水解,故C正确。A、可能氨水浓度小,不能说明。
本题难度:简单
2、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.醋酸的电离平衡常数
D.溶液中的c(OH-)
参考答案:D
本题解析:略
本题难度:一般
3、选择题 常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量(? )
A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-)
B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)
C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L
D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+)
参考答案:B
本题解析:A.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-).错误。B.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-);根据微粒的物质的量的关系可得C(Na+) =C(SO32-)+C(HSO3-) +C(H2SO3)。代入第一个式子,整理可得C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)。正确。C.混合后溶液中的微粒根据物料守恒关系可知: C(SO32-)+C(HSO3-)+C(H2SO3)=(0.01+0.01)÷2="0.01" mol/L.错误。D.两溶液混合前,在Na2SO3溶液中,由于SO32-是H2SO3二级电离产生的离子,而KHSO3溶液中HSO3-是H2SO3一级电离产生的离子,所以SO32-一级水解水解程度大于二级HSO3-的水解程度。水解程度越大,水电离产生的离子浓度越大。因此两溶液混合前,Na2SO3溶液中,水电离出C(H+)大于KHSO3溶液中水电离出C(H+)。错误。
本题难度:一般
4、选择题 用均为0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中?c?(CH3COO-)>c?(Na+),对该混合溶液的下列判断正确的是( )
A.c?(OH-)>c?(H+)
B.c?(CH3COOH)+c?(CH3COO-?)=0.2?mol/L
C.c?(CH3COOH)>c?(CH3COO-?)
D.c?(CH3COO-?)+c?(OH-?)=0.2?mol/L
参考答案:A.CH3COOH和CH3COONa混合溶液中,存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),已知c(CH3COO-)>c(Na+),则c(H+)>C(OH-),故A错误;
B.n(CH3COOH)+n(CH3COO-)=0.2mol,溶液体积为1L,则c(CH3COOH)+c(CH3COO-)=0.2mol?L-1,故B正确;
C.CH3COOH和CH3COONa混合溶液,CH3COOH电离程度大于CH3COO-水解程度,则c(CH3COO-)>c(CH3COOH),故C错误;
D.CH3COOH和CH3COONa混合溶液中,存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),醋酸为弱电解质,存在微弱电离,则有0.1mol/L>c(CH3COOH)>c(H+),c(Na+)=0.1mol/L,则c(CH3COO-)+c(OH-)<0.2mol?L-1,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 用水稀释0.1 mol·L-1 CH3COOH时,溶液中随着水量的增加而减小的是
A.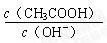
B.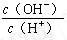
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量