1、选择题 NaHCO3和Na2O2按1∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
A.Na2O2和NaHCO3
B.NaHCO3和Na2CO3
C.NaOH和Na2CO3
D.只有Na2CO3
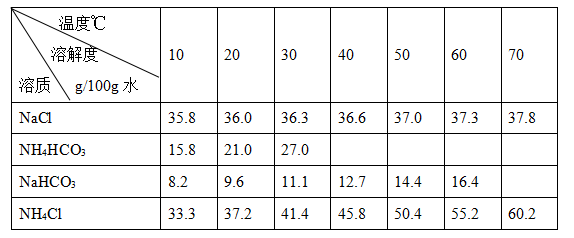
2、填空题 碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置,a 、b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是?。
(2)“转化”的离子方程式是?。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是?;为什么温度控制在30~35℃之间??。
(4)a、b处的操作分别是?、?。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1mL。此时发生的反应为:
CO32-+H+→HCO3-
①样品中碳酸钠质量百分含量的表达式是?。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是?;根据实验数据,如何判断样品含NaHCO3?。
3、选择题 ①钾的密度比水小;②钾的熔点较低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱性。某学生将一小块金属钾投入滴有酚酞试液的水中,此实验能证明上述四点性质中的(?)
A.①④
B.①②④
C.①③④
D.①②③④
4、选择题 把碳酸氢钠溶液滴入下列溶液中,能反应并放出气体的是(?)
A.NaOH溶液
B.石灰水
C.硫酸氢钠溶液
D.氯化铝溶液
5、选择题 下列关于碱金属元素的叙述正确的是(?)
A.它们都能在空气中燃烧生成M2O
B.它们失去电子的能力很强,故在自然界中无游离态存在
C.它们的焰色反应都是黄色
D.它们都能与水反应生成碱和氢气