1、选择题 下列有关实验操作或实验原理正确的是
A.提取溴水中的溴,可用加入乙醇萃取的方法
B.用蒸发溶剂的方法将10%的氯化铁溶液变为20%的氯化铁溶液
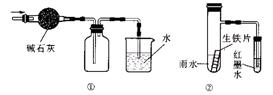
C.用上图①的装置可以收集一瓶干燥的氨气
D.用上图②的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀
2、填空题 (10分)下表中五个小实验,每个小实验有一项未填写,试按要求填空:
3、实验题 某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0mL于锥形瓶,加入10.0 mL KI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1 的Na2S2O3标准液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6 (Na2S4O6溶液为无色)。试回答下列问题:
(1)步骤①加入的指示剂是?。
(2)步骤①反应的离子方程式是 ?。
(3)步聚③当待测液由?色变为?色且30s不再变化即达终点,若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为?。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度?(填“偏大”、“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度?(填“偏大”、“偏小”或“相等”)。
4、选择题 下列叙述正确的是 ( )
A.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出
B.用托盘天平准确称取5.85克NaCl
C.氢氧化钠溶液保存在带玻璃塞的试剂瓶中
D.用广泛PH试纸测得0.10mol/LNH4Cl溶液的PH=5.2
5、选择题 直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH) n (SO4) 3-n/2]m (n>2 , m≤10)的实验流程如下:

已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
(1)实验加入硫酸的作用是?。取样分析Fe2+浓度,其目的是?。
(2)用pH试纸测定溶液pH的操作方法为?。若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数?。(填“偏高”、“偏低”、“无影响”)
(3)氧化时控制反应温度为50~60℃的原因是?。
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]  ?[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为?。
?[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为?。
(5)产品盐基度的测定方法:
Ⅰ 称取m g固体试样,置于400 mL聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。
Ⅱ 室温下放置10 min,再加入10 mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀。
Ⅲ 加入5滴酚酞指示剂,立即用物质的量浓度为c mol·L-1的氢氧化钠标准液滴定至终点,消耗体积为V?ml。
Ⅳ 向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0 ?ml。
①达到滴定终点的现象为?。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为?。