1、选择题 若aAm+与bBn-的核外电子排布相同,则下列关系中不正确的是
[? ]
A.离子半径Am+<Bn-
B.原子半径A<B
C.A的原子序数比B的原子序数大(m+n)
D.b=a-n-m
参考答案:B
本题解析:
本题难度:简单
2、选择题 下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是
| 元素代号 | X | Y | Z | W | N
原子半径/nm
0.186
0.074
0.102
0.099
0.160
主要化合价
+1
-2
-2+6
+7-1
+2
|
( )
A.W、N形成的化合物中含有极性键
B.常温下单质与水反应速率:X>N
C.最高价氧化物对应水化物酸性:W>Z
D.一种18电子的含Y的化合物属于共价化合物
参考答案:X的主要化合价为+1价,且原子半径最大,因为Na元素,Y、Z都有-2价,但只有Z有正价,则Y为O元素,Z为S元素,N的化合价为+2价,原子半径比Na小,应为Mg元素,W的最高化合价为+7价,应为Cl元素,则
A.W、N形成的化合物为离子化合物,不含共价键,故A错误;
B.X为Na,N为Mg,Na较Mg活泼,与水反应剧烈,故B正确;
C.非金属性Cl>S,则最高价氧化物对应水化物酸性:Cl>S,故C正确;
D.一种18电子的含Y的化合物H2S,为共价化合物,故D正确.
故选A.
本题解析:
本题难度:简单
3、简答题 B、C、D、E均是短周期元素,原子序数依次增大,B元素原子最外层上的电子数为内层电子总数的2倍.B元素原子和C元素原子最外层电子数之差为2.C和D形成的化合物进行焰色反应火焰呈黄色.E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物反应.
(1)上述4种元素按照原子序数由大到小排列为______、______、______、______;(填元素符号);
(2)B、C形成的化合物(比空气重)的结构式为______;
(3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为______;X的电子式为______;
(4)E的离子结构示意图为______;
(5)Y是C的气态氢化物.常温下,将D的单质投入Y中,发生反应的离子方程式为______;该反应______(填“能”、“不能”)作为设计原电池的反应原理.
参考答案:B、C、D、E均是短周期元素,B元素原子最外层上的电子数为内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B元素原子和C元素原子最外层电子数之差为2,则C元素原子最外层电子数为6或2,C和D形成的化合物进行焰色反应火焰呈黄色,含有钠元素,则D为Na元素,C不能是金属元素,C的原子序数小于Na,故C为氧元素;E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物NaOH反应,则E为Cl元素,
(1)上述4种元素按照原子序数由大到小排列为:Cl、Na、O、C,
故答案为:Cl;Na;O;C;
(2)C、O形成的化合物(比空气重)为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为 O=C=O,故答案为:O=C=O;
(3)O、Na的单质在加热条件下生成物质X为Na2O2,含有离子键、共价键,其电子式为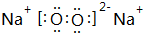 ,
,
故答案为:离子键、共价键; ;
;
(4)E为Cl元素,其离子结构示意图为 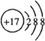 ,故答案为:
,故答案为: ;
;
(5)常温下,将Na的单质投入水中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,该反应属于氧化还原反应,能作为设计原电池的反应原理,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;能.
本题解析:
本题难度:一般
4、填空题 现有A、B、C、D、E五种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1.试回答:
(1)B是______、E是______.(写元素名称):
(2)B的离子结构示意图______,D的单质分子的电子式______,C元素最高价氧化物的水化物的电子式______.
(3)用电子式表示H2A形成过程:______
(4)写出CD的溶液中通入氯气的离子方程式:______
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性:______.
参考答案:A、B、C、D、E五种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体,则A为氧元素;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱,则B为铝元素;
③B为铝元素,C+离子比B3+离子多8个电子,则C为钾元素;
④C与D元素可以形成化合物CD,⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;
⑥C为钾元素,在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1,则E为+1价金属,与钾元素同主族,则E为Cs元素.
(1)由上述分析可知,B是铝元素,E是铯元素,故答案为:铝;铯;
(2)B是铝元素,铝离子有2个电子层,核内质子数为13,最外层有8个电子,铝离子结构示意图
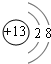
;
D为碘元素,D的单质分子的电子式为
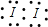
;C为钾元素,C元素最高价氧化物的水化物为KOH,电子式为
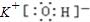
,
故答案为:

;
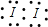
;
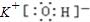
;
(3)A为氧元素,用电子式表示H2O形成过程为
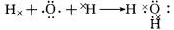
,
故答案为:
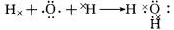
;
(4)氯气具有强氧化性,KI溶液中通入氯气,氯气将碘离子氧化为碘单质,反应的离子方程式2I-+Cl2═I2+2Cl-,故答案为:2I-+Cl2═I2+2Cl-;
(5)B是铝元素,C为钾元素,D是铯元素,金属性Al<K<Cs,所以B、C、E三种元素形成的简单离子氧化性Al3+>K+>Cs+,
故答案为:Al3+>K+>Cs+.
本题解析:
本题难度:一般
5、选择题 下列叙述中能肯定说明金属A比金属B的活泼性强的是
[? ]
A.A原子最外层电子数比B原子最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1molA从酸中置换生成的H2比1molB从酸中置换出的H2多
D.常温时,A能从酸中置换出氢,而B不能
参考答案:D
本题解析:
本题难度:简单