1、选择题 设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是(?)
A.1molCl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
参考答案:B、C
本题解析:Fe过量可使Fe3+还原为Fe2+,A错误。3NO2+H2O==2HNO3+NO,易知B正确。C中,可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果。3Fe+4H2O===Fe3O4+4H2↑,由方程可知D错误。
本题难度:一般
2、选择题
实验室中需要配置2mol/L的NaCl溶液950mL,配置时应选用的容量瓶的规格和称取的NaCl的质量是
[? ]
A.950mL,111.2g
B.500mL,117g
C.1000mL,117g
D.任意规格,111.2g
参考答案:C
本题解析:
本题难度:简单
3、计算题 3.84 g Fe和Fe2O3的混合物溶于过量盐酸中,生成0.03 mol H2,反应后的溶液中加入KSCN溶液检验,溶液不显红色。求原混合物中Fe2O3的质量。
参考答案:1.6g
本题解析:最终溶液中加KSCN溶液不显红色说明其中不含Fe3+,溶质为FeCl2。总反应可表示为Fe+Fe2O3+HCl→FeCl2+H2↑+H2O,设铁的质量为x,由得失电子相等得: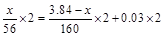 ,解得:x=2.24g。
,解得:x=2.24g。
点评:有关氧化还原反应的计算运用得失电子相等计算可快速解题。
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,通常用6.02×1023 mol-1这个近似值。下列说法正确的是
A.2.3 g金属钠变成钠离子时失去的电子数目为0.2 NA
B.2 g 氢气所含原子数目为NA
C?.17 g NH3所含的电子数目为10 NA?
D.常温常压下,16 g O2和O3的混合物中,约含6.02×1023个氧原子
参考答案:CD
本题解析:钠在反应中失去1个电子,A不正确,2.3 g金属钠变成钠离子时失去的电子数目为0.1NA;2 g 氢气所含原子数目为2NA,B不正确;氨气是10电子分子,17氨气是1mol,C正确;氧气和臭氧都是氧原子构成的不同单质,所以16 g O2和O3的混合物中氧原子的物质的量是1mol,D正确,答案选CD。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系
本题难度:一般
5、选择题 下列说法中,正确的是
A.SO2的摩尔质量是64g
B.18g H2O在标准状况下的体积是22.4L
C.在标准状况下,20mL NH3与60mL O2所含的分子数比为1:3。
D.将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L
参考答案:C
本题解析:SO2的摩尔质量是64g∕mol, H2O在标准状况下不是气体,由阿伏伽德罗定律得出体积之比为物质的量之比也就是分子数之比,C正确。将40g NaOH溶于水中,配成1L溶液,所得溶液的物质的量浓度为1mol/L
本题难度:一般