1、选择题 如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B原子的质量数,B原子的原子核内质子数等于中子数。下列叙述正确的是(?)

A.最高价氧化物对应水化物的酸性:C > B
B.C单质是氧化性最强的非金属单质
C.A的氢化物中具有一定的还原性
D.B在第三周期ⅦA族
参考答案:BC
本题解析:根据题意,设B的原子序数为X,则由元素周期表位置可得A的原子序数为X-9,C的原子序数为X-7,所以可得X-9 +X+X-7=2X,解得X为16,所以A、B、C分别为元素N、S、F。F是非金属性最强的元素,没有含氧酸,所以A错误,B正确;A的氢化物为NH3,氨气有一定还原性,C正确;B为S元素,在第三周期ⅥA族,D错误;故选BC。
本题难度:一般
2、填空题 【化学–选修3:物质结构与性质】(15分)
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是?。两个X2Z分子间的最近距离为?pm(用a和NA表示)。 已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是?kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为?,其核外电子有?种运动状态。
②尿素分子中碳原子的杂化方式为?,1 mol尿素分子中含有的σ键数为?。
③YZ3-的空间构型?。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x=?。
?
参考答案:(15分)(1)3 Mg(NH2)2==Mg3N2+4NH3↑ (2分)
(2) 水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键(2分)
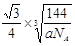 ?×1010(2分)? 20(1分)
?×1010(2分)? 20(1分)
(3)①1s22s22p63s23p63d8(2分) 26 (1分)
②sp2杂化(1分)? 7NA(1分)?③平面三角(1分)?④0.97 (2分)
本题解析:Z基态原子最外层电子数是其内层电子总数的3倍,根据元素原子的最外层不超过8电子的排布规律判断,Z的内层只能是2个电子,最外层为6个电子,所以Z是O元素;Y基态原子是同周期元素中未成对电子数最多的原子,则Y是第二周期元素,其最外层的p轨道最多有3个未成对电子,所以Y是N元素;X分别与Y、Z元素组合均可形成10电子微粒, 水、氨气的分子中是10电子,所以X是H元素;W基态原子有10个价电子,则W是过渡元素,价层电子排布式为3d84s2,所以W是Ni元素。根据分析
(1)Mg(YX2)2相当于Mg(OH)2,分解生成MgO和H2O,所以Mg(YX2)2分解生成Mg3N2和4NH3,化学方程式为3 Mg(NH2)2==Mg3N2+4NH3↑;
(2)0℃时H2O为固态,水中的O和金刚石中的C都是sp3杂化,且水分子间能形成氢键,氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键,所以冰的空间排列方式与金刚石晶胞类似;
两个X2Z分子间的最近距离的计算与金刚石中C与C原子的最近距离的计算相同,冰晶胞中共含8个水分子,2个水分子最近的距离是四面体的中心到顶点的距离,即为晶胞棱长的 ,设晶胞棱长是bpm,则晶胞的密度a=8×18/NA/(b×10-10)3,b=
,设晶胞棱长是bpm,则晶胞的密度a=8×18/NA/(b×10-10)3,b=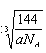 ×1010,所以两个X2Z分子间的最近距离为
×1010,所以两个X2Z分子间的最近距离为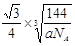 ×1010;冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol;
×1010;冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol;
(3)①Ni2+核外有26个电子,所以离子的核外电子排布式为1s22s22p63s23p63d8;有26个电子就有26种运动状态;
②尿素分子中碳原子周围有3个σ键,无孤对电子,所以是sp2杂化;尿素分子中除碳氧是双键外其余均是单键,双键中有1个是σ键,所以1 mol尿素分子中含有的σ键数为7NA;
③NO3-的价层电子对数=3+1/2(5+1-3×2)=3,所以NO3-的空间构型是平面正三角形;
④NiO中Ni的化合价为+2价,样品中W3+与W2+的离子数之比为6∶91,若该晶体的化学式为WxZ,根据晶体仍呈电中性,得6/97×x×3+91/97×x×2=2,解得x=0.97.
本题难度:一般
3、选择题 放射性同位素钬16667Ho的原子核内的中子数是(?)
A.99
B.67
C.166
D.32
参考答案:A
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可知该核素的质子数=67,质量数=166。又因为质子数+中子数=质量数,则中子数=166-67=99,答案选A。
点评:该题是高考中的常见题型,属于进行试题的考查。重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:简单
4、选择题 有四组同族元素的物质,在101.3KPa时测定它们的沸点(0C)如下表所示:
第一组?
| He? -268.8?
| (a)? -249.5?
| ?Ar? -185.8?
| Kr? -151.7?
|
第二组?
| F2? -187.0?
| Cl2?-33.6?
| ?(b)? 58.7?
| I2? 184.0
|
第三组
| (c)? 19.4?
| ?HCl? -84.0
| ?HBr? -67.0?
| HI? -35.3
|
第四组
| H2O? 100.0?
| ?H2S? -60.2
| (d)? -42.0?
| H2Te? -1.8
|
?
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为c分子量最大
D.第四组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
参考答案:D
本题解析:第一组物质为稀有气体的单质,都是单原子分子,则a为Ne,而不是Ne2,故A错误;氟元素一般无正化合价,则F2只表现氧化性,不表现还原性,但氯、溴、碘都有正化合价,因此Cl2、Br2、I2既能表现氧化性,又能表现还原性,故B错误;HF的相对分子质量最小,但其沸点却最高,因为HF分子间存在氢键,故C错误;非金属性:O>S>Se>Te,非金属性越强,该元素的气态氢化物越稳定,故D正确。
本题难度:简单
5、选择题 砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是(?)
A.砷在通常情况下是固体
B.可以存在-3、+3、+5等多种化合价
C.砷的还原性比磷弱
D.As2O5对应水化物的酸性比H3PO4弱
参考答案:C
本题解析:同主族自上而下非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,D正确。同主族元素性质和结构是相似的,所以AB都是正确的。非金属性越强,相应阴离子的还原性越弱,所以选项C是错误的。答案选C。
本题难度:简单