1、选择题  某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu(?NO3)2、HN03物质的量浓度之比为
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu(?NO3)2、HN03物质的量浓度之比为
A.1:1:1
B.1:3:1
C.2:1:4
D.1:1:4
参考答案:D
本题解析:分析:依据氧化还原反应的顺序规律分析计算,溶液中含有Fe?(NO3)?3、Cu?(NO3)?2、HNO3,氧化性顺序为HNO3>Fe?(NO3)?3>Cu?(NO3)?2,加入铁后依次反应.
解答:稀溶液中各物质的氧化性顺序为HNO3>Fe?(NO3)?3>Cu?(NO3)?2,加入铁后会依次发生氧化还原反应,
①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+;
从图象中可知铁为1mol时,无Fe2+生成,发生的反应是①消耗硝酸为4mol,生成Fe3+1mol;
再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;
再加入1mol铁发生反应③,此时又生成Fe2+物质的量为1mol,说明原溶液中Cu2+物质的量为1mol;
综上所述可知原溶液中Fe?(NO3)?3为1mol,Cu?(NO3)?2物质的量为1mol,HNO3物质的量为4mol,物质的量浓度之比为1:1:4;
故选D.
点评:本题考查了铁及其化合物的性质应用,主要考查氧化还原反应的顺序反应规律及计算应用.
本题难度:困难
2、选择题 下列关于Na2CO3和NaHCO3的性质的比较中,不正确的是
A.热稳定性Na2CO3>NaHCO3
B.常温下在水中的溶解度Na2CO3>NaHCO3
C.与稀盐酸反应的剧烈程度Na2CO3>NaHCO3
D.等物质的量浓度的Na2CO3和NaHCO3溶液的PH:Na2CO3>NaHCO3
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列金属或氧化物可以完全溶解的是
A.1molZn与含1molHCl的稀溶液共热
B.1molCu与含4molHNO3的浓硝酸
C.1molCu与含2molH2SO4的浓硫酸共热
D.1molMnO2与含4molHCl的浓盐酸共热
参考答案:B
本题解析:
本题难度:困难
4、选择题 下列化合物中,能由两种单质直接化合生成的是
A.Fe3O4
B.C2H4
C.NO2
D.SO3
参考答案:A
本题解析:正确答案:A
A、3Fe+2O2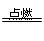 Fe3O4符合题意。B、来源于石油裂解;C、N2+O2
Fe3O4符合题意。B、来源于石油裂解;C、N2+O2 2NO,得不到NO2;?D、S+O2
2NO,得不到NO2;?D、S+O2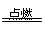 SO2,不生成SO3
SO2,不生成SO3
本题难度:一般
5、选择题 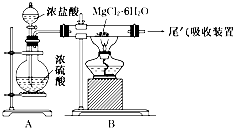 如图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
如图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl2?6H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
参考答案:B
本题解析:分析:该制备原理是在HCl的环境下,加热MgCl2?6H2O晶体,防止水解,制备无水氯化镁.
A、装置A的作用是产生HCl气体,通入B装置防止镁离子水解;
B、直接镁离子水解,不能得到无水氯化镁,可能得到Mg(OH)Cl或MgO;
C、实验尾气中含有HCl,浓硫酸不能吸收HCl;
D、Mg可以在二氧化碳中燃烧.
解答:该制备原理是在HCl的环境下,加热MgCl2?6H2O晶体,防止水解,制备无水氯化镁.
A、装置A的作用是产生HCl气体,装置A中圆底烧瓶中可以换成固体MnO2,不能产生HCl气体,故A错误;
B、直接镁离子水解,不能得到无水氯化镁,可能得到Mg(OH)Cl或MgO,故B正确;
C、实验尾气中含有HCl,会污染空气,浓硫酸不能吸收HCl,可以用水吸收,需放倒吸,故C错误;
D、Mg可以在二氧化碳中燃烧,mg失火不能用二氧化碳灭火器进行灭火,故D错误;
故选B.
点评:考查学生对实验原理的理解、盐类水解、Mg元素单质及化合物的性质等,难度中等,注意基础知识的理解掌握.
本题难度:简单