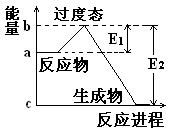
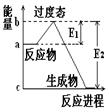
1、填空题 (1) 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图, 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
参考答案:(1) 放热 大于
(2)0.125mol/Lmin 3.5mol
本题解析:(1)反应物的总能量高于生成物的总能量,因此该反应时放热反应。所以反应物二氧化氮与一氧化碳的总能量大于产物二氧化碳与一氧化氮的总能量。(2)据题意可算出一氧化氮的速率为0.5除以2再除以2等于0.125 mol/Lmin,化学速率之比等于化学计量数之比,而一氧化碳与一氧化氮的化学计量数比为1;1所以,二氧化碳的速率为0.125mol/Lmin 。NO2+CO CO2+NO,2 min生成了0.5摩尔的一氧化氮,则也会生成0.5摩尔的二氧化碳。同时也会消耗0.5摩尔的一氧化碳和二氧化氮。所以剩余的一氧化碳为2减去0.5等于1.5,剩余的二氧化氮为1.5减去0.5等于1摩尔。所以容器内气体的总物质的量为1.5+1+0.5+0.5等于3.5摩尔
CO2+NO,2 min生成了0.5摩尔的一氧化氮,则也会生成0.5摩尔的二氧化碳。同时也会消耗0.5摩尔的一氧化碳和二氧化氮。所以剩余的一氧化碳为2减去0.5等于1.5,剩余的二氧化氮为1.5减去0.5等于1摩尔。所以容器内气体的总物质的量为1.5+1+0.5+0.5等于3.5摩尔
考点:考查化学反应与能量以及化学反应速率的相关知识
本题难度:一般
2、选择题 下列每组物质发生变化所克服的粒子间的作用不属于同种类型的是
A.金刚石和金属钠熔化
B.碘和干冰受热升华
C.氯化钠和氯化钙熔化
D.氯化氢和溴化氢溶于水
参考答案:A
本题解析:A、金刚石和金属钠形成的晶体分别是原子晶体和金属晶体,熔化克服的作用力分别是共价键和金属键,A正确;B、碘和干冰形成的晶体均是分子晶体,升华克服的是分子间作用力,B不正确;C、氯化钠和氯化钙形成的晶体均是离子晶体,熔化克服的是离子键,C不正确;D、氯化氢和溴化氢溶于水均电离出离子,克服的是共价键,D不正确,答案选A。
本题难度:一般
3、选择题 下列过程中,共价键被破坏的是(?)
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤冰融化 ⑥NH4Cl“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
A.①④⑥⑦
B.④⑥⑧
C.①②④⑤
D.④⑥
参考答案:D
本题解析:①碘升华破坏的是分子间作用力,错误。 ②溴蒸气被木炭吸附破坏的是分子间作用力,错误。 ③酒精溶于水破坏的是分子间作用力,错误。 ④HCl气体溶于水,在水分子的作用下断裂共价键H—Cl键,电离产生自由移动的H+和Cl-.正确。⑤冰融化破坏的是分子间作用力,错误。⑥NH4Cl“升华”就是在加热时发生反应NH4Cl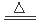 NH3↑+HCl↑,化学键断裂。正确。⑦氢氧化钠是离子化合物,熔化时断裂离子键。错误。 ⑧(NH4)2SO4溶于水在水分子的作用下断裂离子键。错误。
NH3↑+HCl↑,化学键断裂。正确。⑦氢氧化钠是离子化合物,熔化时断裂离子键。错误。 ⑧(NH4)2SO4溶于水在水分子的作用下断裂离子键。错误。
本题难度:一般
4、选择题 根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=
参考答案:
本题解析:
本题难度:一般
5、填空题 (14分)NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
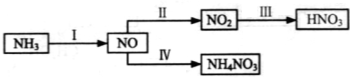
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
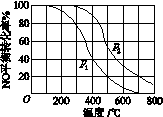
①比较p1、p2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
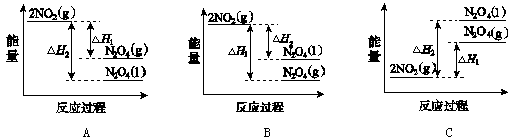
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
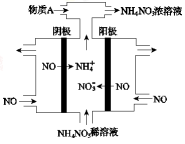
为使电解产物全部转化为NH4NO3,需补充A。A是 ,说明理由: 。
参考答案:(14分)
(1)4NH3+5O2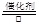 4NO+6H2O
4NO+6H2O
(2)①p1<p2 ②减小
(3)①A ②2N2O4+O2+2H2O===4HNO3
(4)NH3根据反应:8NO+7H2O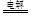 3NH4NO3+2HNO3,电解产生的HNO3多
3NH4NO3+2HNO3,电解产生的HNO3多
本题解析:(1)氨在催化剂的作用下与氧气反应生成NO和水,其化学方程式是4NH3+5O2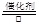 4NO+6H2O。
4NO+6H2O。
(2)①2NO(g)+O2(g)  2NO2(g),该反应是气体体积减小的可逆反应,增大压强,平衡向右移动,NO的平衡转化率升高,所以p1、p2的大小关系为p1<p2;②升高温度,NO的平衡转化率降低,说明平衡逆向移动,而升高温度,平衡向吸热反应方向移动,则该反应的正向反应是放热反应,对于放热反应,升高温度,化学反应平衡常数减小。
2NO2(g),该反应是气体体积减小的可逆反应,增大压强,平衡向右移动,NO的平衡转化率升高,所以p1、p2的大小关系为p1<p2;②升高温度,NO的平衡转化率降低,说明平衡逆向移动,而升高温度,平衡向吸热反应方向移动,则该反应的正向反应是放热反应,对于放热反应,升高温度,化学反应平衡常数减小。
(3)①2NO2(g) N2O4(g)ΔH1和2NO2(g)
N2O4(g)ΔH1和2NO2(g) N2O4(l)ΔH2都是放热反应,反应物的能量高于生成物的能量,C图错误;同一物质气态时的能量高于液体时的能量,A图正确;B图错误;选A。
N2O4(l)ΔH2都是放热反应,反应物的能量高于生成物的能量,C图错误;同一物质气态时的能量高于液体时的能量,A图正确;B图错误;选A。
②N2O4与O2、H2O反应生成硝酸,化合的化学方程式是2N2O4+O2+2H2O===4HNO3。
(3)根据电解示意图可知,电解NO制备硝酸铵,阳极反应为:NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出若要使电子得失守恒,阳极产生的NO3-的量大于阴极产生的NH4+的量,总反应为8NO+7H2O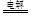 3NH4NO3+2HNO3,应补充适量的氨气,则理由为根据反应8NO+7H2O
3NH4NO3+2HNO3,应补充适量的氨气,则理由为根据反应8NO+7H2O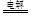 3NH4NO3+2HNO3,电解产生的HNO3多。
3NH4NO3+2HNO3,电解产生的HNO3多。
考点:考查化学反应的书写,影响化学平衡的因素,化学图像的分析及电解的应用。
本题难度:困难