1、选择题 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH4++Fe3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++ 3SO42-+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH4++ Fe3++3SO42-+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
参考答案:BC
本题解析:
复盐NH4Fe(SO4)2中Fe的化合价是+3价,因此选项A不正确;又因为NH4Fe(SO4)2还可以形成(NH4)2SO4·Fe2(SO4)3的形式,因此当Ba(OH)2不足时选项C也有可能发生,故正确答案为BC。
本题难度:一般
2、填空题 在小河的两岸分别有甲、乙两个工厂,它们向小河排出的污水中共含有Fe3+、Cl-、OH-、Na+、H+、CO32-、SO42-、Ca2+等八种离子,甲厂污水呈黄色,乙厂污水无色透明,两厂污水交汇处有明显的浑浊并产生大量的气泡,如果甲、乙两厂的污水中各含有四种离子,则:
甲厂污水中含有的离子是______;
乙厂污水中含有的离子是______;
两厂污水交汇处发生反应的离子方程式(有几个写几个)______.
参考答案:甲厂污水呈黄色,说明含有大量的Fe3+,Fe3+和OH-、CO32-离子会生成沉淀,则OH-、CO32-应存在于乙厂中,
Ca2+和SO42-、CO32-离子会生成沉淀,乙厂中含有CO32-,则Ca2+应存在于甲厂中,SO42-存在于乙厂中,
H+与OH-、CO32-反应而不能共存,则H+应存在于甲厂中,
所以甲厂含有Fe3+、Ca2+、H+等离子,根据溶液电中性原则,还应含有Cl-,
乙厂含有OH-、CO32-、SO42-等离子,根据溶液电中性原则,还应含有Na+,
两厂污水交汇处有明显的浑浊并产生大量的气泡发生反应的离子方程式有:
2H++CO32-=CO2↑+H2O,H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Ca2++CO32-=CaCO3↓,Ca2++SO42-=CaSO4↓等,
故答案为:Fe3+、Ca2+、H+、Cl-;OH-、CO32-、SO42-、Na+;
2H++CO32-=CO2↑+H2O,H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Ca2++CO32-=CaCO3↓,Ca2++SO42-=CaSO4↓.
本题解析:
本题难度:简单
3、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为?。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是?;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol
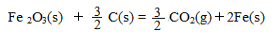 ?△H = +230 kJ/mol
?△H = +230 kJ/mol
C(s)+O2(g) = CO2(g)?△H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是?,铝热反应属于______(填字母)反应。
a.氧化还原? b.复分解? c.置换
参考答案:(1)NO3- + Al +H2O→ Al(OH)3 + N2 + OH-(2分)? 5∶3
(2)O2+4e-+2H2O=4OH-? 1.5
(3)2 Al(s) + Fe2O3 (s)= 2 Fe(s) +Al2O3 (s)?△H = - 600 kJ/mol ?a c
本题解析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al为还原剂,则Al(OH)3为氧化产物,再根据电荷守恒和原子守恒可得:NO3- + Al +H2O→ Al(OH)3 + N2 + OH-;Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知,x×(3-0)=y×(5-0),解得x:y=5:3,所以被氧化与被还原的元素的物质的量之比为5∶3。
(2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,正极反应为2H2O+O2+4e-=4OH-;Al元素由0价升高为+3价,则 Al~3e?,所以消耗13.5 g Al时转移电子:13.5g÷27g/mol×3=1.5mol。
(3)首先写出化学方程式并注明各物质的状态,然后根据盖斯定律求出?H,?H="1/2" ?H1+?H2 – 3/2 ?H3=- 600 kJ?mol?1,可写成热化学方程式;铝热反应发生了化合价的变化,为氧化还原反应,反应物为一种单质和一种化合物,生成了一种新的单质和一种新的化合物,也属于置换反应,故a、c选项正确。
本题难度:一般
4、简答题 2g?Cu2S和CuS的混合物在酸性溶液中用400mL?0.075mol/L?KMnO4溶液处理,反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的?KMnO4恰好与350mL?0.1mol/L?(NH4)2Fe(SO4)2?溶液完全反应,反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(1)KMnO4溶液与混合物反应,消耗KMnO4的物质的量为______mol.
(2)欲配制500mL?0.1mol/L?NH4+?溶液,需称取?(NH4)2Fe(SO4)2?6H2O?(M=392g/mol)的质量为______g.
(3)混合物中?Cu2S的质量分数为______.
参考答案:(1)设消耗高锰酸钾xmol,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol? 5mol
xmol? 0.350L×0.1mol/L?
所以x=0.007,
高锰酸钾的总物质的量为0.400L×0.075mol/L=0.03mol,
所以KMnO4溶液与混合物反应,消耗KMnO4的物质的量为0.03mol-0.007mol=0.023mol,
故答案为:0.023mol;
(2)设(NH4)2Fe(SO4)2?6H2O?的物质的量为ymol,
(NH4)2Fe(SO4)2?6H2O----2NH4+
? 1mol?2mol
?ymol?0.500L×0.1mol/L?
y=0.025,
所以其质量为m=nM=0.025mol×392g/mol=9.8g;
故答案为:9.8g;
(3)设Cu2S的物质的量为mmol,CuS的物质的量为nmol,
8MnO4-+44H++5Cu2S=10Cu2++5SO2+8Mn2++22H2O
8? ?5
8m5mol? mmol?
6MnO4-+28H++5CuS=5Cu2++5SO2+6Mn2++14H2O
6?5?
6n5mol? nmol
所以列方程组为:
本题解析:
本题难度:一般
5、选择题 下列离子方程式书写正确的是( )
A.烧碱溶液与小苏打溶液反应:OH-+HCO3-=H2O+CO2↑
B.铝粉与烧碱溶液反应:2Al+2OH-+6H2O=2[Al(OH)]4-+2H2↑
C.氯化亚铁溶液中滴加氯水:2Fe2++Cl2=2Fe3++2Cl-
D.氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O
参考答案:A.烧碱溶液与小苏打溶液反应生成CO32-,反应的离子方程式为OH-+HCO3-=H2O+CO32-,故A错误;
B.铝粉与烧碱溶液反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)]4-+3H2↑,故B错误;
C.Fe2+具有还原性,与氯气发生氧化还原反应生成Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故C正确;
D.氯气通入冷的氢氧化钠溶液中,反应的离子方程式应为Cl2+2OH-=Cl-+ClO-+H2O,故D错误.
故选C.
本题解析:
本题难度:简单