1、填空题 (15分)
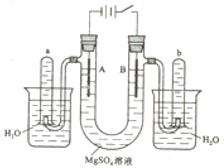
右图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,减色—黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是(填编号);
①A管溶液由红变黄;②B管溶液由红变黄;
③A管溶液不变色;④B管溶液不变色;
(2)写出A管中发生反应的反应式:;
(3)写出B管中发生反应的反应式:;
(4)检验a管中气体的方法是;
(5)检验b管中气体的方法是;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是。
参考答案:
(1)①④
(2)
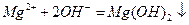
(3)
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰(2分)
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内会复燃(2分)
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)(3分)
本题解析:略
本题难度:简单
2、选择题 如图,电解用粗盐(含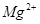 、
、 、
、 等杂质)配制的食盐水,以下说法正确的是
等杂质)配制的食盐水,以下说法正确的是

A.a是电解池的正极
B.a电极上发生还原反应
C.b电极附近有白色沉淀出现
D.b电极上有黄绿色气体产生
参考答案:C
本题解析:
正确答案:C
A.不正确,a与电源正极相连,是电解池的阳极;B.不正确,a电极上发生氧化反应
C.正确,2H2O+2e-=H2+2OH― ,Mg2++2OH―=Mg(OH)2 ,b电极附近有白色沉淀出现? D.b电极上有无色气体产生。
本题难度:一般
3、选择题 如右图所示,a、b是两根石墨棒,下列叙述正确的是( )
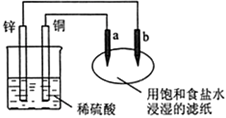
A.a是正极,发生还原反应,b是阴极,发生还原反应
B.装置工作时,稀硫酸溶液中C(H+)变小、C(Cu2+)变大
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
参考答案:D
本题解析:铜、锌、稀硫酸形成原电池,锌做负极,铜做正极,b 和负极相连,b 是阴极,a 和正极相连,a 是阳极。故A 错误;
B.错误,装置工作时,氢离子在正极得电子,所以,稀硫酸溶液中C(H+)变小、没有Cu2+。
C 错误,氯离子在a电极放电,往滤纸上滴加酚酞试液,a极附近颜色不变
D 正确,硫酸根离子不放电,所以,硫酸根离子的物质的量不变。
本题难度:一般
4、填空题 现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl 2。请回答下列问题:
⑴在电解过程中,与电源正极相连的电极上所发生的电极反应式为?。
⑵电解之前,食盐水需要精制,目的是除去粗盐中的、Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为(填试剂序号)?。
⑶如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)Cl2,这时溶液的pH值是?(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)?。
⑷若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是?
?。
参考答案:⑴2Cl-→ Cl2↑+2e-;⑵b、a、c;⑶升高,0.1mol·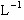 ;⑷NaCl+H2O
;⑷NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
本题解析:此题是在考查电解食盐水的基础之上,同时考查粗盐的精制。解题时,要紧扣电解原理,电子守恒分析。⑴与电源正极相连的是阳极,阴离子Cl-放电,电极反应式为:2Cl-→ Cl2↑+2e-。⑵加入Ba(OH)2后过量的Ba2+应该用Na2CO3溶液除去,最后加入盐酸除去,并调节溶液的酸碱性(加盐酸之前,必须过滤,否则沉淀又溶解了)。⑶电解饱和食盐水过程中产生了NaOH,使溶液的碱性增强,pH值升高;依据总方程式:2NaCl+2H2O 2NaOH+H2↑+Cl 2↑知,n(OH-)= 2n(Cl 2)=2×
2NaOH+H2↑+Cl 2↑知,n(OH-)= 2n(Cl 2)=2× ?= 1.0 mol ,则c(OH-)=
?= 1.0 mol ,则c(OH-)= ?=0.1mol·
?=0.1mol·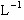 ?。⑷由于Cl 2+ 2NaOH= NaCl + NaClO + H2O,与电解食盐水的总反应方程式2NaCl+2H2O
?。⑷由于Cl 2+ 2NaOH= NaCl + NaClO + H2O,与电解食盐水的总反应方程式2NaCl+2H2O 2NaOH+H2↑+Cl 2↑相加,可得:NaCl+H2O
2NaOH+H2↑+Cl 2↑相加,可得:NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
本题难度:一般
5、简答题 (12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
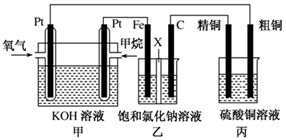
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成 的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
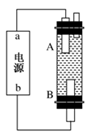
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
参考答案:(12分) (1) CH4 +10OH- -8e-=CO32-+7H2O ;(3分)
(2)2Cl--2e-=Cl2↑;(2分) (3)4.48L,(2分) 12.8g;(2分)
(4) 负(1分) 饱和氯化钠溶液或食盐水(1分) 铁 (1分)
本题解析:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极。
(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,氧气的物质的量是2.24L÷22.4L/mol÷0.1mol,则则转移电子的物质的量=0.1mol×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg,则
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
解得x=4.48
Cu 2++2e-=Cu
2mol 64g
0.4mol yg
解得y=12.8
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极,所以a为电池负极;若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,如果阳极是惰性电极,阳极上氢氧根离子放电生成氧气得不到氢氧化亚铁,所以阳极上应该是铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁。
考点:考查原电池和电解池原理及物质的量的有关计算
本题难度:一般