1、选择题 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离平衡常数,若已知下列反应可以发生:①NaCN+HNO2=HCN+NaNO2,②NaCN+HF=HCN+NaF,③NaNO2+HF=HNO2+NaF,由此可判断下列叙述不正确的是
A.K(HF)=7.2×10-4
B.K(HCN)<K(HNO2)<K(HF)
C.根据①③两个反应即可知三种酸的相对强弱,相同条件下HCN的酸性最弱
D.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同
参考答案:D
本题解析:根据强酸制取弱酸规律,由①③两个反应可知三种弱酸的强弱顺序为HF>HNO2>HCN。相同温度下,酸的酸性越强,其电离平衡常数越大,由此可判断K(HCN)<K(HNO2)<K(HF),对应的数据依次为K(HF)=7.2×10-4,K(HNO2)=4.6×10-4,K(HF)=4.9×10-10。故A、B、C正确。相同温度下,同一弱电解质的电离常数不随浓度发生变化,故D不正确。故答案选D。
本题难度:一般
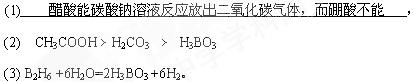
2、填空题 向两支分别盛有0.1mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1) 三种酸由强到弱的顺序是(用化学式表示)(2) ,]硼酸(H3BO3)在食品、医药领域应用广泛。
(3) 请完成B2H6气体与水反应的化学方程式:B2H6 +6H2O=2H3BO3 +________。
(4) 在其他条件相同时,反应H3BO3 +3CH3OH  B(OCH3)3 +3H2O中,H3BO3的转化率(
B(OCH3)3 +3H2O中,H3BO3的转化率( )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
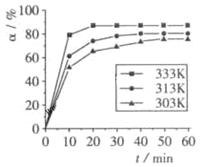
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(5) H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)
[B(OH)4]-( aq)+H+(aq)
已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K= ,
(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
参考答案:
(4) ①温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应
②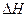 >0
>0
( 5) K=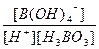 =
=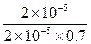 =
=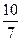 或1.43
或1.43
本题解析:略
本题难度:困难
3、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中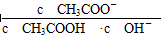 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:本题考查弱电解质的电离平衡,意在考查考生对电离平衡的理解和应用能力。醋酸溶液加水稀释后,CH3COOH的电离程度增大,n(H+)、n(CH3COO-)增大,A项错误;根据CH3COOH的电离平衡常数Ka=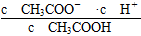 =
= ,则
,则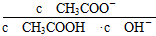 =
=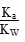 ,由于温度不变,Ka、KW均不变,因此
,由于温度不变,Ka、KW均不变,因此 不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。
不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。
本题难度:一般
4、选择题 将4.0?g氢氧化钠固体分别加入下列100?mL溶液中,溶液的导电能力变化不大的是
[? ]
?①自来水 ②3.65?g?HCl ③6.0?g醋酸 ④5.35?g?NH4Cl
A.①② ?
B.②③
C.③④?
D.②④
参考答案:D
本题解析:
本题难度:一般
5、填空题 ⑵(12分) 18℃时,H2A(酸):K1=4.3×10-7,K2=2.1×10-12。H2B(酸):K1=1.0×10-7,K2=6.3×10-13,在浓度相同的两种溶液中,用“>”、“<”或“=”填空。
①H+的浓度:H2A________H2B;
②酸根离子的浓度:c (A2-)________c (B2-);
③酸分子的浓度:c (H2A)________c (H2B);
④溶液的导电能力:H2A________H2B。
参考答案:①> ②> ③< ④>
本题解析:(1)相同温度、相同浓度的不同二元酸溶液中,c(H+)与电离平衡常数成正比,多元弱酸的电离以第一步为主,H2A的K1大于H2B,所以H2A电离程度大,溶液中c(H+)大;(2)相同温度、相同浓度下,电离平衡常数越大其电离程度越大,H2A的K2大于H2B,所以酸根离子的浓度c(A2-)> c(B2-);(3)相同温度、相同浓度下,电离平衡常数越大,其电离程度越大,H2A的K1大于H2B,所以H2A电离程度大,酸分子的浓度c(H2A)< c(H2B);(4)相同温度、相同浓度的不同二元酸溶液,c(H+)与电离平衡常数成正比,多元弱酸的电离以第一步为主,H2A的K1大于H2B,所以H2A的电离程度大,溶液中离子浓度H2A>H2B。
考点:弱电解质在水溶液中的电离平衡
点评:本题考查弱电解质的电离,明确电离平衡常数与电离程度的关系是解答本题的关键。
本题难度:一般