1、填空题 (4分)写出下列反应的热化学方程式。
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ的热量。
__________________________________________________
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ。
_______________________________________________________________
参考答案:每小题2分,共4分。
(1)S(s) + O2(g) ="=" SO2(g) ?△H=-296KJ/mol
(2)2Al(s)+ 3Cl2(g) ="=" 2AlCl3(s)?△H=-1645.2KJ/mol
本题解析:略
本题难度:一般
2、选择题 在一定条件下,A和B反应可生成C和D,其能量变化如下:

下列有关反应A+B=C+D的说法正确的是(?)
A.反应前后原子的种类和数目可能改变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需加热反应就一定能进行
D.该反应遵循能量守恒,所以一定有能量变化
参考答案:D
本题解析:A选项,错误,在化学反应中原子的种类和数目一定不发生改变。B选项,错误。凡是化学反应,都将伴随着能量的变化。故不一定为氧化还原反应。C选项错误。有很多放热反应在反应前需加热达到反应温度才能进行反应,如铝热反应 ,有机物燃烧等。D选项正确。
本题难度:一般
3、选择题 强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+ OH-(aq) → H2O (l) +57.3kJ
向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应Q1、Q2、Q3的关系正确的是
A.Q1 < Q2 < Q3
B.Q1 > Q3 > Q2
C.Q2 > Q1 > Q3
D.Q1 < Q3 < Q2
参考答案:D
本题解析:稀醋酸是弱电解质,电离时需吸收能量,与1molNaOH溶液放出的能量低于57.3 kJ;浓硫酸溶解时放热,1molNaOH放出的能量大于57.3 kJ;稀硝酸与1mol NaOH溶液反应放出的热量为57.3 kJ。
本题难度:一般
4、选择题 关于下列四个图像的说法中正确的是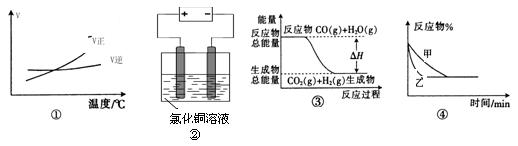

A.图①表示可逆反应“A2(g)+B2(g) 2AB3(g)”的ΔH大于0
2AB3(g)”的ΔH大于0

B.图②是在电解氯化铜稀溶液的电解池中,阴、阳极产生气体的物质的量之比一定为1:1

C.图③表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0

D.图④表示压强对可逆反应2A(g)+B(g) 3C(g)+D(s)的影响,甲的压强大
3C(g)+D(s)的影响,甲的压强大
参考答案:C
本题解析:略
本题难度:一般
5、填空题 某同学进行如下实验,检验化学反应中的能量变化.
实验中发现反应前后①中的温度升高而②中的温度降低,由此判断Al与盐酸的反应是______热反应、Ba(OH)2?8H2O与NH4Cl的反应是______热反应.试写出①中反应的离子方程式:______.
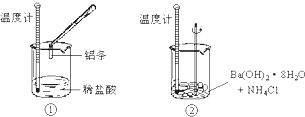
参考答案:通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低,根据温度升高,反应放热,温度降低,反应吸热,所以Al跟盐酸的反应是放热反应,Ba(OH)2?8H2O跟NH4Cl的反应是吸热反应,Al跟盐酸反应方程式为:2Al+6HCl═2AlCl3+3H2↑,则离子方程式为:2Al+6H+═2Al3++3H2↑,
故答案为:放;吸;2Al+6H+═2Al3++3H2↑.
本题解析:
本题难度:一般