1、选择题 下列除去氯化亚铁溶液中的铁粉最简单的操作方法是
A.过滤
B.萃取
C.升华
D.结晶
参考答案:A
本题解析:分析:除去氯化亚铁溶液中的铁粉,可用过滤的方法.
解答:铁粉不溶于水,可用过滤的方法分离,而萃取、升华、结晶都不符合,
故选A.
点评:本题考查物质的分离、提纯,题目难度不大,注意常见分离操作使用的范畴.
本题难度:一般
2、填空题 1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
H:2.1
| ?
| ?
| ?
| ?
| ?
| ?
|
Li:1.0
| Be:1.5
| B:2.0
| C:2.5
| N:3.0
| O:3.5
| F:4.0
|
Na:0.9
| Mg:1.2
| Al:1.5
| Si:1.8
| P:2.1
| S:2.5
| Cl:3.0
|
K:0.8
| Ca:1.0
| Ga:1.6
| Ge:1.8
| As:2.0
| Se:2.4
| Br:2.8
|
Rb:0.8
| Sr:1.0
| In:1.7
| Sn:1.8
| Sb:1.9
| Te:χ
| I:2.5
|
Cs:0.7
| Ba:0.9
| Tl:1.8
| Pb:1.9
| Bi:1.9
| Po:2.0
| At:2.2
|
Fr:0.7
| Ra:0.9
| ?
| ?
| ?
| ?
| ?
|
?
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解:?;?
⑵预测Te元素χ的值?;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小??;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程?。
参考答案:⑴每隔一定数目的元素,后面元素性质的变化重复前面元素性质变化的规律
⑵2.0<χ<2.4?⑶吸引电子的能力
⑷ (或写成双聚分子形式)
(或写成双聚分子形式)
本题解析:略
本题难度:简单
3、填空题 (12分)今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为?堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
第一电离能
| 电负性
| 晶格能
| 沸点
|
Mg?Al
| O?S
| MgO?MgS
| H2O?H2S
|
(3)基态铬原子外围电子轨道表示式为?。
参考答案:(1)六方;(2)>;>;>;>?(3)
本题解析:⑴镁晶体堆积方式属于六方堆积;
⑵Mg的第一电离能大于Al的第一电离能(反常);O的非金属性比S大,故其电负性比S大;S2-离子半径比O2-离子半径大,故MgO的晶格能比MgS大;H2O分子间存在有氢键,故H2O的沸点比H2S高;
⑶基态铬原子的电子排布式为[Ar]3d54s1,则其外围电子轨道表示式为 。
。
本题难度:一般
4、填空题 (24分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
?主族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
2
| ?
| ?
| ?
| ①
| ②
| ③
| ?
| ?
|
3
| ④
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ⑧
|
4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)在这些元素中,化学性质最不活泼的是:?(写元素符号)该原子结构示意图为?。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是?,碱性最强的化合物的化学式是:?。
(3)最高价氧化物是两性氧化物的元素是?;写出它的氧化物与氢氧化钠溶液反应的离子方程式?。
(4)形成的单质硬度最大的元素是?该单质的晶体类型为?
(5)用电子式表示元素④与⑥形成的化合物:?,该化合物属于?化合物。(填 “共价”或“离子”)
(6)元素①与⑦形成的最简单的化合物的电子式是?。该化合物属于?化合物。(填 “共价”或“离子”)
参考答案:(1)? Ar?(2)? HClO4? KOH
(3)? Al? Al2O3+2OH-=2AlO2-+H2O?(4)? C?原子晶体
(5)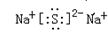 ?离子?(6)
?离子?(6)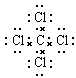 ?共价
?共价
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断,①~⑨分别是C、N、O、Na、Al、S、Cl、Ar、K。
(1)稀有气体元素的最外层已经达到8电子稳定结构,其化学性质最不活泼。
(2)非金属性越强,最高价氧化物水化物的酸性越强,金属性越强,最高价氧化物水化物的碱性越强。同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下金属性逐渐增强,非金属性逐渐减弱。所以最活泼的金属是K,非金属是Cl。
(3)氢氧化铝是两性氢氧化物,能溶于强碱氢氧化钠溶液中,方程式为Al2O3+2OH-=2AlO2-+H2O。
(4)金刚石的硬度增大,形成的晶体是原子晶体。
(5)钠是活泼的金属性元素,和硫形成的化学键是离子键,硫化钠的电子式为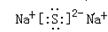 。
。
(6)碳和氯都是非金属元素,形成的化学键是极性键,其化合物是共价化合物,电子式为
本题难度:简单
5、选择题 下表为第2、3周期某些元素性质的数据。下列说法正确的是
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径/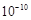 m m
| 0.73
| 1.30
| 1.34
| 1.06
| 0.99
| 1.54
| 0.75
| 1.02
|
最高或最低化合价
|
| +2
| +1
| +5
| +7
| +1
|
| +6
|
-2
|
|
|
|
|
| -3
|
|
A.③和⑤处于同一周期
B.气态氢化物的稳定性④大于⑧
C.上述八种元素最高价氧化物对应的水化物,⑤的酸性最强
D.①与⑥只能形成一种化合物
参考答案:C
本题解析:略
本题难度:一般