1、选择题 为除去MgCl2溶液中的NaCl杂质,下列实验操作及其顺序正确的是
[? ]
①过滤 ②滴加过量的氢氧化钠溶液 ③滴加过量的硝酸银溶液 ④滴加适量的稀盐酸 A.②①④
B.①③④
C.①②④
D.②④③
参考答案:A
本题解析:
本题难度:一般
2、选择题 在某未知溶液中加入硝酸银溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水中,石灰石变浑浊,由此判断该溶液中含有
A.Cl- SO42-
B.Cl- NO3-
C.Cl- CO32-
D.Cl- OH-
参考答案:C
本题解析:①由已知条件“加入硝酸银溶液,产生白色沉淀”可知,生成的沉淀为氯化银或碳酸银;
②因为氯化银不溶于稀硝酸,由已知条件“加入足量稀硝酸,沉淀部分溶解”可知,放出能使澄清石灰水变浑浊的气体的沉淀是碳酸银,所以溶液中含有碳酸根。剩余沉淀为氯化银。
故原溶液含有Cl- CO32-。
点评:此题主要是考查同学们的综合分析能力,不但要求同学们具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断。
本题难度:一般
3、选择题 下列实验可行的是?(? )
A.可用激光笔区别淀粉溶液和食盐溶液
B.加入盐酸以除去硫酸钠中的少许碳酸钠杂质
C.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D.除去BaSO4固体中混有的BaCO3:加过量硫酸后,过滤、洗涤
参考答案:A
本题解析:淀粉溶液是胶体,有丁达尔现象;B项会引入新的杂质NaCl;配制FeCl3胶体无需用NaOH溶液,否则会生成Fe(OH)3沉淀;D项中不能是硫酸,生成硫酸钡阻止反应继续进行。
本题难度:一般
4、选择题 向2mL 0.5mol·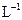 的
的 溶液中加入3mL 5mol·
溶液中加入3mL 5mol·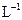 KF溶液,发现
KF溶液,发现 溶液渐渐褪至无色,再加入KI溶液和
溶液渐渐褪至无色,再加入KI溶液和 振荡后,静置,不见
振荡后,静置,不见 层有紫红色,则下列说法正确的是( )
层有紫红色,则下列说法正确的是( )
A.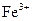 不与
不与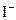 发生反应
发生反应
B.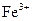 与
与 结合成不与
结合成不与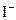 反应的物质
反应的物质
C.F-使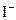 的还原性减弱
的还原性减弱
D.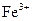 被F-还原为
被F-还原为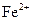 ,使溶液中不再存在
,使溶液中不再存在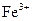
参考答案:B
本题解析: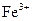 与
与 易形成络合物
易形成络合物
本题难度:一般
5、计算题 现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3-?(2)部分物理参数如下:
?
| 密度
(g·mL-1)
| 熔点
(℃)
| 沸点
(℃)
| 溶解性
|
苯甲酸
| 1.2659
| 122.13℃
| 249℃
| 微溶于水,易溶于乙醇、乙醚等有机溶剂
|
苯酚
| 1.07
| 40.6
| 181.9
| 易溶于乙醇、乙醚,65℃以上能与水互溶
|
乙醇
| 0.79
| -114.3 °C
| 78.5
| 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂
|
?
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下:
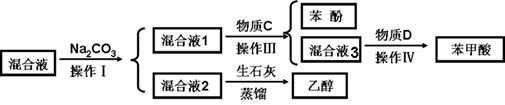
①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________? _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
实验步骤
| 现象和结论
|
①取少量混合液1于试管,滴加________________________,
振荡,静置
| ?
|
②取少量步骤①上层清夜于试管,滴加__________________
____________________________________________________
| 澄清石灰水变浑浊
说明混合液1含有HCO3-
|
③另取少量混合液1于试管,滴加___________________,振荡
| ?
_________________________,
说明混合液1不含有酚羟基
|
?
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
参考答案:(17分)
①CO2?(2分)?过滤(2分)
②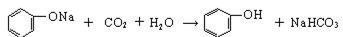 (2分)
(2分)
③生石灰与混合液2中的水反应,生成氢氧化钙溶液,便于乙醇从混合物中蒸馏出来(意思相同也得分)(2分)
(2)
实验步骤
现象和结论
①取一定量试样于试管,加入足量0.1mol/L BaCl2(1分),
?
②取少量步骤①上层清夜于试管,滴加足量的 0.1mol/L盐酸, 再将产生的气体通入澄清石灰水中(2分)
?
②另取少量试样于试管,滴加少量0.1mol/L? FeCl3溶液(1分),(或者少量浓溴水),振荡
?
溶液不显紫色(或不出现白色的沉淀)(1分),
?
(3) 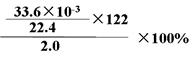 ?(2分)? 9.2%(2分)
?(2分)? 9.2%(2分)
本题解析:(1)①由于酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3-,则苯甲酸和苯酚的乙醇溶液与碳酸钠混合时,苯甲酸与碳酸钠反应,生成苯甲酸钠、二氧化碳和水,苯酚与碳酸钠反应生成苯酚钠和碳酸氢钠,而乙醇与碳酸钠都不反应;读图可得,混合液1的主要成分是苯甲酸钠、苯酚钠、碳酸氢钠、碳酸钠等物质,混合液2的主要成分是乙醇等物质;根据酸性强弱顺序,则物质C是碳酸或二氧化碳气体,苯酚钠与碳酸或二氧化碳和水发生复分解反应,生成苯酚、碳酸氢钠,而苯甲酸钠与碳酸或二氧化碳和水不反应,则混合液3的主要成分是苯甲酸钠和碳酸氢钠等物质;物质D是盐酸或HCl,盐酸与苯甲酸钠发生复分解反应,生成苯甲酸和氯化钠,盐酸与碳酸氢钠发生复分解反应,生成氯化钠、二氧化碳气体和水;由于苯甲酸微溶于水,则盐酸与苯甲酸钠反应容易形成苯甲酸的过饱和溶液时,可以析出苯甲酸晶体,从溶液中分离出苯甲酸晶体的操作IV是过滤;②略;③生石灰为氧化钙,CaO是碱性氧化物,容易与水反应,生成溶沸点较高的氢氧化钙,而乙醇与氧化钙不反应,且乙醇的溶沸点较低,蒸馏时乙醇容易从混合物中分离;(2)由于碳酸钠过量,则混合液1中可能含有苯甲酸钠、苯酚钠、碳酸氢钠、碳酸钠等物质,其中碳酸钠能干扰碳酸氢钠的检验,因此步骤①应先取样,再加入过量0.1mol/L BaCl2,振荡,静置,将碳酸根离子完全沉淀为碳酸钡,排除碳酸根离子对碳酸氢根离子的干扰;根据步骤②中现象和结论逆推,由于碳酸氢根离子在强酸作用下可以变为二氧化碳气体,说明向步骤①的上层清液中滴加足量0.1mol/L盐酸,再将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,说明溶液1中含有碳酸氢根离子;由于步骤2中加入过量盐酸可以将苯酚钠转变为苯酚,因此步骤③需要另取混合液1,由于苯酚遇氯化铁溶液显紫色,苯酚钠遇氯化铁溶液不变色,苯酚遇浓溴水反应生成白色沉淀,苯酚钠遇浓溴水不能产生白色沉淀,因此向样品中加入0.1mol/L FeCl3或浓溴水,振荡,溶液不显紫色(或不出现白色的沉淀),说明混合液1不含有酚羟基或苯酚;(3)先求二氧化碳的物质的量(33.6×10-3/22.4mol),再根据苯甲酸与饱和碳酸氢钠溶液反应中苯甲酸与二氧化碳的系数之比等于物质的量之比求苯甲酸的物质的量(33.6×10-3/22.4mol),然后根据摩尔质量求苯甲酸的质量(33.6×10-3/22.4mol×122g/mol),最后根据混合固体的质量求苯甲酸的质量分数,即[33.6×10-3/22.4mol×122g/mol]÷2.0g×100%=9.15%≈9.2%。
本题难度:一般