|
高中化学知识点大全《键参数——键能、键长与键角》高频考点强化练习(2019年最新版)(四)
2020-07-28 06:02:27
【 大 中 小】
|
1、填空题 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
A.CO2
B.H3O+
C.CH4
D.H2SO4
| (2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:___________________。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
甲: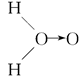 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________________________________________________________。
参考答案:(1)BD
(2)H3BO3+H2O H++[B(OH)4]- H++[B(OH)4]-
(3) 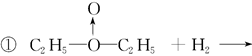 ? ?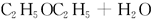
②用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
本题解析:本题综合考查配位键的形成和配合物的性质。解题时要注意配位键形成条件中的一方提供孤对电子,另一方提供空轨道。
(1)由题中信息可导出结论:凡能给出H+的物质中一般含有配位键。
(2)硼原子为缺电子原子,H3BO3的电离实质是B原子和水中的OH-形成配位键,水产生的H+表现出酸性。
(3)由题中所含配位键的物质的反应特点分析。
本题难度:一般
2、简答题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是______(填名称),W在周期表中的位置______.
(2)X与Y?形成化合物的电子式为______,X与W组成的化合物中存在______键(填“离子”“共价”).
(3)写出实验室制备YX3的化学方程式:______
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知1mol?A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.则A的名称是______.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol?B中含有6mol结晶水.对化合物B进行如下实验:
a.?取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;b.?另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解则B的化学式为______.
参考答案:根据原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N,Z为O,W为S,
(1)X为H,其名称为氢,W为S,位于元素周期表中第三周期第ⅥA族,故答案为:氢;第三周期第ⅥA族;
(2)H原子最外层有1个电子,N原子最外层有5个电子,则氨气的电子式为
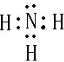
,H、S之间以共用电子对形成化合物,则以共价键结合,
故答案为:
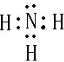
;共价;
(3)①实验室制取氨气利用氯化铵与碱石灰共热来反应得到,该反应为2NH4Cl+Ca(OH)2??△?.?CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2??△?.?CaCl2+2NH3↑+2H2O;
(4)X、Y、Z、W四种元素组成的一种离子化合物中的阳离子为NH4+,阴离子为硫酸根离子或硫酸氢根离子,但1mol?A能与足量NaOH浓溶液反应生成标准状况下44.8L气体,
则1molA中含有2molNH4+,则A为硫酸铵,故答案为:硫酸铵;
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,由B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色可知B中含有Fe2+、NH4+,另取B的溶液,加入过量
BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol?B中含有6mol结晶水,由相对分子质量为
392及化合物中正负化合价的代数和为零可知,B为(NH4)2Fe?(SO4)2?6H2O,故答案为:(NH4)2Fe?(SO4)2?6H2O.
本题解析:
本题难度:一般
3、简答题 现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构
X
最外层电子数是次外层电子数的3倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
第三周期元素的简单离子中半径最小
|
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是______,元素Z的离子结构示意图为______.
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论______.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为______.
(4)元素X与元素Y相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______.
a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b.?X的单质比Y的单质更容易与H2?化合
c.X与Y形成的化合物中Y元素呈正价态.
参考答案:短周期元素中,最外层电子数是次外层电子数的3倍,即第一层电子数为2,第二层电子数为6,则X为氧元素;常温下单质为双原子分子,其氢化物水溶液呈碱性,即氢化物为氨气,则Y为氮元素;第三周期元素的简单离子中半径最小,阴离子的半径大于阳离子的半径,金属离子中原子序数越大的半径最小,则Z为铝元素;
(1)因氧元素的单质臭氧具有强氧化性,则可在生活中常用作饮水机的消毒剂,铝离子的质子数为13,核外电子数为10,其结构示意图为
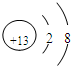
,
故答案为:O3;
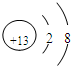
;
(2)因铵根离子能与碱反应生成氨气,且氨气能使湿润的红色石蕊试纸变蓝,故答案为:取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子;
(3)Z元素最高价氧化物对应的水化物,Al(OH)3与NaOH的反应为Al(OH)3+NaOH=NaAlO2+2H2O,离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;?
(4)因N、O元素处于同周期,同周期随原子序数的增大,非金属在增强,故O元素的非金属强,a中的氧化还原反应可判断氧气的氧化性大于氮气的氧化性,则氧的非金属性大于氮元素的非金属性,b中与氢气的化合的难易程度可知氧的非金属性强,c中氧比氮元素容易得到电子,则氧的非金属强,故答案为:O;a,b,c.
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是( )
A.乙醇的结构简式为:C2H6O
B.硫离子的结构示意图为: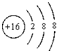
C.NaHCO3电离:NaHCO3=Na++H++CO32-
D.H2O的电子式:
参考答案:A.乙醇的官能团为羟基,乙醇的结构简式为CH3CH2OH,故A错误;
B.硫离子核外电子数为18,硫离子的结构示意图为 ,故B正确; ,故B正确;
C.碳酸氢钠为强电解质,溶液中完全电离生成钠离子和碳酸氢根离子,NaHCO3电离方程式为NaHCO3=Na++HCO3-,故C错误;
D.H2O为共价化合物,分子中没有离子,电子式为 ,故D错误; ,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 下列化学用语书写不正确的是( )
A.醛基官能团符号:-CHO
B.硝基苯的结构简式: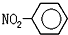
C.丙烷分子的球棍模型示意图: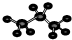
D.-OH与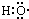 都表示羟基 都表示羟基
参考答案:A.醛基中碳原子含有一个单电子,碳原子和氧原子之间以共价双键结合,碳原子和氢原子之间以共价单键结合,所以醛基官能团符号为:-CHO,故A正确;
B.硝基苯的结构简式为: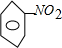 ,故B错误; ,故B错误;
C.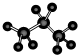 原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故C正确; 原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故C正确;
D.羟基中氧原子含有一个单电子,氧原子和氢原子以共价单键结合,所以-OH与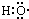 都表示羟基,故D正确; 都表示羟基,故D正确;
故选B.
本题解析:
本题难度:一般
|  、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。