1、填空题 X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收。已知X是化石燃料燃烧的产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应。请写出下列反应的化学方程式。
(1)X溶于雨水,形成酸雨?;
(2)Y与NaOH溶液反应?;
(3)Z与水反应? 。
参考答案:(1)SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4
(2)Cl2+2NaOH=NaCl+NaClO+H2O
(3)3NO2+H2O=2HNO3+NO
本题解析:
本题难度:一般
2、简答题 某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(:NO2?21℃;-NO-152℃)
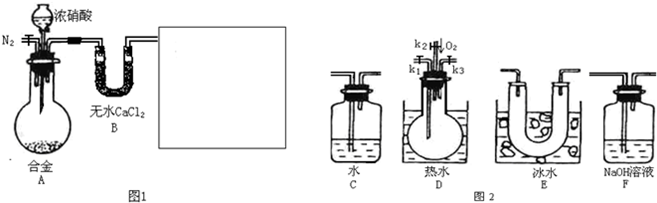
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为______
(2)反应前先通入N2目的是______
(3)确认气体中含NO的现象是______
(4)如果O2过量,则装置F中发生反应的化学方程式为:______
(5)反应结束后,关闭开关将烧瓶拿出后的现象为______给出合理的解释______
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为______.
参考答案:(1)因属与浓硝酸反应会生成二氧化氮,要验证NO的生成,则先冷却使二氧化氮与NO分离,则选择E装置,验证NO的存在,利用其与氧气反应生成红棕色气体,则选择D装置,
氮的氧化物对环境有污染,不能排放在环境中,应利用碱处理尾气,则选择F装置,所选择仪器的连接顺序为E→D→F,故答案为:E→D→F;
(2)因NO易被氧化,若装置中存在氧气则不能说明NO的存在,所以反应前先通入N2目的是排尽装置中的空气,防止NO被氧化,故答案为:排尽装置中的空气,防止NO被氧化;
(3)因NO与氧气反应生成二氧化氮,则观察到D中烧瓶内通入O2后,无色气体变成红棕色,
故答案为:D中烧瓶内通入O2后,无色气体变成红棕色;
(4)因氧气过量发生4NO2+O2+2H2O=4HNO3,硝酸与碱反应生成硝酸钠,整个过程的化学反应为4NO2+O2+4NaOH=4NaNO3,
故答案为:4NO2+O2+4NaOH=4NaNO3;
(5)2NO2?N2O4 △H<0,则将烧瓶拿出后,气体温度降低,平衡2NO2?N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅,
故答案为:气体颜色变浅;烧瓶拿出后,气体温度降低,平衡2NO2?N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅;
(6)由M+4HNO3═M(NO3)2+NO2↑+2H2O,只生成二氧化氮时,被还原硝酸的物质的量n为a2mol,
由3M+8HNO3═3M(NO3)2+2NO↑+4H2O,只生成一氧化氮,被还原硝酸的物质的量n为a4mol,
以上两个反应都发生,则被还原硝酸的物质的量a4mol<n<a2mol,故答案为:a4mol<n<a2mol.
本题解析:
本题难度:一般
3、简答题 烟气中NOx是NO和NO2的混合物(不含N2O4).
(1)根据废气排放标准,1m3烟气最高允许含400mgNOx.若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO______L(标准状况,保留2位小数).
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为______mol/L(保留2位小数).
(3)已知:
NO+NO2+Na2CO3→2NaNO2+CO2?①
2NO2+Na2CO3→NaNO2+NaNO3+CO2?②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气______排放标准(填“符合”或“不符合”),理由:______
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3→3NO2+H2O当烟气中n(NO):n(NO2)=2:3时,吸收率最高.
lm3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1.
计算:
(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数).
(ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速.计算结果保留1位小数).
参考答案:(1)NO的最大质量为400mg×0.85=340mg,NO的体积为0.34g30g/mol×22.4L/mol=0.25L,故答案为:0.25;
(2)该碳酸钠溶液物质的量浓度为1000×1.16×0.15106mol/L=1.64mol/L,故答案为:1.64;
(3)未被被吸收的NOx的质量为2000mg×(1-80%)=400mg,因吸收后烟气总体积减小,NOx含量仍超过400mg/m3,故不符合,故答案为:不符合,吸收后烟气总体积减小,NOx含量仍超过400mg/m3;
(4)(i)由于n(NO):n(NO2)=9:1,则30×n(NO)+19n(NO)×46=2,解得n(NO)=0.057mol令需要加入的硝酸为2x,根据方程式NO+2HNO3→3NO2+H2O可知,反应的n(NO)=x、生成n(NO2)=3x,则(0.057-x):(19×0.057+3x)=2:3,解得x=0.0176mol,故n(HNO3)=2x=0.035mol,
答:为了达到最高吸收率,1m3烟气需用硝酸的物质的量0.035mol;
(ii)发生反应NO+NO2+Na2CO3→2NaNO2+CO2、2NO2+Na2CO3→NaNO2+NaNO3+CO2,由方程式可知n(NaNO2)=2n(NO)+12[n(NO2)-n(NO)]=32n(NO)+12n(NO2)=32×(0.057mol-0.0176mol)+12×(19×0.057mol+3×0.0176mol)=0.0887mol,所以m(NaNO2)=0.0887mol×69g/mol×90%=5.5g,
答:吸收后生成NaNO2的质量为5.5g.
本题解析:
本题难度:一般
4、选择题
将充有n?mLNO和m?mLNO2气体的试管倒立于盛水的水槽中,然后通入n?mLO2.m>n,则充分反应后,试管中气体在同温同压下的体积为( )
A.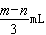 ? ? ? ? ? ? ? ?B.style="http://picflow.91exam.org/upload/papers/g05/20150213/20150213094306939346.png">? ? ? ? ? C.style="http://picflow.91exam.org/upload/papers/g05/20150213/20150213094306955364.png">? ? ? ? ? D.style="http://picflow.91exam.org/upload/papers/g05/20150213/20150213094306970339.png">
? ? ? ? ? ? ? ?B.style="http://picflow.91exam.org/upload/papers/g05/20150213/20150213094306939346.png">? ? ? ? ? C.style="http://picflow.91exam.org/upload/papers/g05/20150213/20150213094306955364.png">? ? ? ? ? D.style="http://picflow.91exam.org/upload/papers/g05/20150213/20150213094306970339.png">
参考答案:A
本题解析:
本题难度:一般
5、简答题 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(1)用化学方程式表示NO形成硝酸型酸雨的反应______
(2)能作脱除剂的物质很多,下列说法正确的是______
a.用?H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用?Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2.
Ⅰ.已知可通过下列方法合成尿素:
2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)?CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______
②写出有利于尿素释放NH3的条件并说明理由______
Ⅱ.CO(NH2)2与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a?对应CO(NH2)2?与NO的物质的量比值是______.
②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______.
③900℃~1200℃区间内脱除率下降,NO浓度上升.发生的主要反应是______.
④曲线a中,NO的起始浓度为6×10-4?mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______?mg/(m3?s).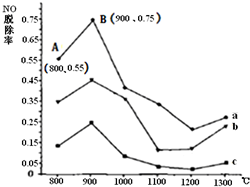
参考答案:(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,故NO形成硝酸型酸雨的反应为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO,故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO;
(2)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;
?b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;
C.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;
故答案为:ab;
(3)①已知:2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)?CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
根据盖斯定律,两热化学方程式相加得2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(l)△H=-131kJ/mol,
故尿素释放出NH3的热化学方程式为:CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol,
故答案为:CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol;
②释放氨气的反应是吸热反应,升高温度,有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行,
故答案为:升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行;
Ⅱ.①CO(NH2)2?的含量越高,NO的转化率越大,即NO脱除率越高,所以曲线a?对应CO(NH2)2?与NO的物质的量比值是3:1,故答案为3:1;
②800℃~900℃区间内NO脱除率增大,所以NO是作为反应物参加反应,高温时,尿素分解生成氨气、二氧化碳,氨气和一氧化氮发生氧化还原反应生成氮气,即尿素与NO反应生成N2,同时生成二氧化碳和水,所以反应方程式为:4NH3+6NO═5N2+6H2O?或?2CO(NH2)2+6?NO═2CO2+4H2O+5N2,
故答案为:4NH3+6NO═5N2+6H2O?或?2CO(NH2)2+6?NO═2CO2+4H2O+5N2;
③900℃~1200℃区间内脱除率下降,所以NO浓度上升,则该反应中应该有NO,尿素分解生成的氨气和烟气中的氧气反应生成一氧化氮和水,导致NO浓度增大,所以反应方程式为:4NH3+5O2═4NO+6H2O,
故答案为:4NH3+5O2═4NO+6H2O;?
④A点到BNO脱除率由0.55变为0.75,故NO的浓度变化量为(0.75-0.55)×6×10-4?mg/m3=1.2×10-4?mg/m3
所以NO的脱除速率=1.2×10-4mg/m30.8s=1.5×10-4mg/(m3.s),
故答案为:1.5×10-4.
本题解析:
本题难度:一般