1、简答题 下列反应的离子方程式正确的是( )
A.铝粉投入到少量NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
C.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
D.铁粉加入三氯化铁溶液中:Fe+2Fe3+=3Fe2+
参考答案:A.得失电子不相等,正确的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故A错误;
B.HClO为弱电解质,正确的离子方程式为Cl2+H2O=H++Cl-+HClO,故B错误;
C.氨水为弱电解质,,正确的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.Fe3+具有氧化性,与Fe反应生成Fe2+,反应的离子方程式为Fe+2Fe3+=3Fe2+,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 能正确表示下列反应的离子方程式是(?)
A.在碳酸氢钙溶液中加入盐酸: HCO3-+H+=CO2↑+H2O
B.把金属铁放入稀H2SO4中:2Fe+6H+=2Fe3++3H2↑
C.向 FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
D.Na2S溶于水:S2-+2H2O=H2S↑+2OH-
参考答案:A
本题解析:A中碳酸氢钙是可溶性的强电解质,可写成Ca2+与HCO3-,故离子方程式是正确的;B中稀硫酸只能将Fe氧化成Fe2+,不符合客观事实;C中电荷不守恒,离子方程式应是:2Fe2++Cl2=2Fe3++2Cl-;D中S2-的水解是分步的,且是微弱的,应为S2-+H2O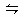 HS-+OH-。
HS-+OH-。
本题难度:简单
3、选择题 下列离子方程式书写正确的是
[? ]
A.Na2O2与水的反应:Na2O2+H2O=2Na++2OH-+O2↑
B.CO2通入Na2CO3溶液中:CO2+CO32-+H2O=2HCO3-
C.澄清石灰水中通入足量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.小苏打溶液中加入过量盐酸:CO32-+2H+=CO2↑+H2O
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列离子方程式中,正确的是(?)
A.稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2↑
B.氧化镁和稀盐酸混合:MgO +2H+ = Mg2+ + H2O
C.铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
D.稀盐酸滴在石灰石上:CO32- + 2H+ = H2O + CO2↑
参考答案:B
本题解析:试题分析:铜与稀硫酸不反应,与浓硫酸在加热的条件下才反应,A错;氧化镁为碱性氧化物与酸反应生成对应的盐和水,B正确;铜比银活泼,会置换出银,但该离子方程式电荷不守恒,C错;碳酸盐与酸反应分步发生,先生成碳酸氢根,再生成二氧化碳,当酸不足时仅生成碳酸氢根,D错。
点评:离子方程方是高中化学中考察的重点,重在考察学生对离子方程式书写的熟练程度,如离子方程式的书写应符合客观实事,电荷应守恒,微溶物,难溶物及弱电解质不可拆成离子式等几项注意事项。本题难度属中等
本题难度:简单
5、选择题 下列反应的离子方程式正确的是( )
A.铜溶于浓硝酸:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
B.氯化铝溶液与过量氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O
C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
参考答案:A.铜溶于浓硝酸的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故A正确;
B.氯化铝溶液与过量氨水反应的离子反应为Al3++3NH3?H2O=A(OH)3↓+3NH4+,故B错误;
C.氯气与水反应的离子反应为Cl2+H2O=H++Cl-+HClO,故C错误;
D.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+H2O+Ca2++ClO-=CaSO4↓+2H++Cl-,故D错误;
故选A.
本题解析:
本题难度:简单