1、实验题 新装修的居室内,甲醛浓度往往很大.严重污染空气.居住者接触时间较长易得白血病。1×10—5mol·L—1的紫色KMnO4溶液遇甲醛气体即褪色。用下面的微型化学实验可测定室内空气甲醛含量:
(1) 试设计实验,在中学实验室里配制100mL l.00×10-4mol·L-1KMnO4溶液;
(2) 用2.5mL注射器准确量取2mL l.00×10—4mol·L—1KMnO4溶液,注入六孔穴板1*孔内,加入3滴6 mol·L—1H2SO4溶液,盖好塞子;按图连接好装置。将此装置置于待测地点,缓慢抽气,每次抽气50mL,直到溶液红色褪去,记录抽气次数。已知有关反应为:5HCHO+4KMnO4+6H2SO4 5CO2+11H2O+2K2SO4+4MnSO4
5CO2+11H2O+2K2SO4+4MnSO4
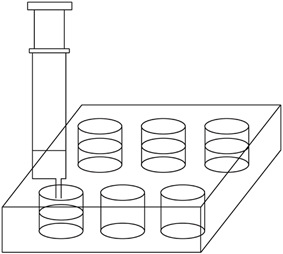
(3) 设抽气次数为n,试计算甲醛在空气中的含量(mg/m3)。
(4) 若室内空气中甲醛气体最高允许浓度为20mg·m-3试分析讨论室内空气符合标准时n的取值范围。
(5) 为保证实验结果精确性,实验过程中应注意什么?
参考答案:(1)准确称取1.9gKMnO4用少量水溶解,转移入1000mL容量瓶中,定容。再准确取此溶液1mL于100mL容量瓶中定容,得到1.00×10-4mol·L-1KMnO4溶液。(3) 150/n(mg/m3) (4) n≥8符合标准(5)抽气时应慢慢地抽拉活塞,否则反应不完全,测定结果偏低。KMnO4应随配随用。
本题解析::涉及微型实验的考核值得关注,本题属于定量实验的考查,着重考查学生处理实验数据的能力和实事求是的科学态度。如浓度的配制,若缺乏处理数据的能力,就会导致用天平去称量质量很小的高锰酸钾,这在中学实验中是达不到的。(1) 准确称取1.9gKMnO4用少量水溶解,转移入1000mL容量瓶中,定容。再准确取此溶液1mL于100mL容量瓶中定容,得到1.00×10-4mol·L-1KMnO4溶液。 (3) 150/n(mg/m3) (4) n≥8符合标准(5)抽气时应慢慢地抽拉活塞,否则反应不完全,测定结果偏低。KMnO4应随配随用(想一想,如何从题意中得出这个区分度较大的答案的)。
本题难度:一般
2、实验题 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究。?
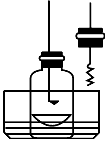
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤2:引燃燃烧匙中的试剂,塞好瓶塞。燃烧结束后,调节广口瓶内外液面相平。
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升。
步骤4:取蒸发皿中得到的固体,加盐酸溶解。向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体。
(1)为除去广口瓶中的氧气,燃烧匙中最好应装入下列试剂中的______________(填序号) 。
A.炭粉 B.铁粉 C.红磷
(2)步骤2中调节内外液面相平的方法:_________________________
(3)写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式:_________________________。
(4)某同学直接将镁条在空气中点燃,并将所得白色固体进行步骤4的实验,结果无气体生成,其原因是_________________________。
(5)兴趣小组同学为比较镁和铝的金属性强弱,设计了下表中的实验方案一,请你再设计一种不同的实验方案。实验试剂和用品:镁条、铝条、0.1mol·L-1MgCl2溶液、0.1 mol·L-1AlCl3溶液、0.1mol·L-1
HCl溶液、0.1mol·L-1 NaOH 溶液、pH 试纸(其他实验仪器可任选)

参考答案:(1)C
(2)向水槽中加水
(3)Mg3N2+8HCl==3MgCl2+2NH4Cl
(4)氧气比氮气活泼,与镁反应生成MgO
(5)在MgCl2溶液和AlCl3溶液中分别加NaOH溶液至过量;MgCl2溶液中产生沉淀且不消失,AlCl3溶液中产生沉淀后完全溶解
本题解析:
本题难度:困难
3、实验题 某化学科外活动小组所做实验如图所示:图中→表示气流方向,M是纯净干燥的气体,Y是另一种气体,E内有红棕色气体产生,实验所用药品只能在下列物质中选用:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、NH4HCO3碱石灰、蒸馏水。
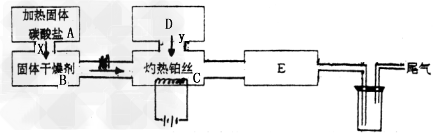
填写下列空白:
(1)A中所用装置的主要仪器有:___________________。
(2)B中选用的干燥剂是_________,其作用是_______________。
(3)C中发生的主要化学方程式为____________________ 。
(4)D中制取Y的化学方程式为____________________ 。
参考答案:(1)大试管,铁架台(带铁夹)、酒精灯
(2)碱石灰 ;吸收CO2和H2O,干燥NH3
(3)4NH3+5O2=4NO+6H2O?
(4)2Na2O2+2H2O=4NaOH+O2↑
本题解析:
本题难度:一般
4、填空题 (12分)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:

步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①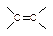 +IBr →
+IBr →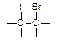
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
⑴已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用?▲?,用方程式表示碘瓶必须干燥的原因?▲?。
⑵步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是?▲?。
⑶步骤Ⅲ中所加指示剂为?▲?,滴定终点的现象?▲?。
⑷反应结束后从液体混合物中回收四氯化碳,则所需操作有?▲?。
参考答案:⑴酸式滴定管(或移液管)? IBr+H2O=HIO+HBr
⑵碘瓶置于暗处可以减少IBr的挥发,不断摇动可以让物质间充分反应。
⑶淀粉溶液?溶液由蓝色恰好变为无色
⑷分液、蒸馏
本题解析:略
本题难度:一般
5、简答题 实验室用加热1-丁醇、溴化钠和浓H2SO4的混合物的方法来制备1-溴丁烷时,还会有烯、醚等副产物生成.反应结束后将反应混合物蒸馏,分离得到1-溴丁烷,已知相关有机物的性质如下:
| ? | ?熔点/℃ | ?沸点/℃
?1-丁醇
-89.53
?117.25
?1-溴丁烷
-112.4
?101.6
?丁醚
-95.3
?142.4
?1-丁烯
-185.3
-6.5
|

(1)制备1-溴丁烷的装置应选用上图中的______(填序号).反应加热时的温度不宜超过100℃,理由是______.
(2)制备操作中,加入的浓硫酸必需进行稀释,其目的是______.(填字母)
a.减少副产物烯和醚的生成?b.减少Br2的生成
c.减少HBr的挥发?d.水是反应的催化剂
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是______.该操作应控制的温度(t)范围是______.
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是______.(填字母)
a.NaI?b.NaOH?c.NaHSO3?d.KCl.
参考答案:(1)实验室用加热1-丁醇、溴化钠和浓H2SO4的混合物的方法来制备1-溴丁烷时,发生反应生成产物中含有易溶于水的溴化氢,还会有烯、醚等副产物生成,吸收装置需要防倒吸;制备1-溴丁烷的装置应选用上图中C;1-溴丁烷沸点101.6,反应加热时的温度不宜超过100℃,防止1-溴丁烷因气化而逸出,影响产率;
故答案为:C;防止1-溴丁烷因气化而逸出,影响产率;
(2)a.浓硫酸和1-丁醇反应发生副反应消去反应生成烯烃、分子间脱水反应生成醚,稀释后不能发生类似反应减少副产物烯和醚的生成,故a正确;
b.浓硫酸具有强氧化性嫩氧化溴离子为溴单质,稀释后减少Br2的生成,故b正确;
c.反应需要溴化氢和1-丁醇反应,浓硫酸溶解溶液温度升高,使溴化氢挥发,稀释后减少HBr的挥发,故c正确;
d.水不是反应的催化剂,故d错误;
故答案为:abc;
(3)反应结束后将反应混合物蒸馏,分离得到1-溴丁烷,应选用的装置为D,体积图表数据温度应控制在101.6℃≤t<117.25℃;
故答案为:D;101.6℃≤t<117.25℃;
(4)欲除去溴代烷中的少量杂质Br2,
a.NaI和溴单质反应,但生成的碘单质会混入,故a不选;
b.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故b不选;?
c.溴单质和NaHSO3 溶液发生氧化还原反应可以除去溴单质,故c选;
d.KCl不能除去溴单质,故d不选;
故答案为:c.
本题解析:
本题难度:一般