| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《离子方程式的书写及正误判断》试题强化练习(2019年最新版)(四)
参考答案:AB 本题解析:A、二者不管多少都生成硫酸钡沉淀,现象都相同,选A;B、氯化镁和氨水反应不管多少都生成氢氧化镁沉淀,现象相同,选B;C、碳酸钠和少量盐酸反应生成碳酸氢钠和氯化钠,没有气体,和过量盐酸反应生成氯化钠和二氧化碳,有气体,所以不选C;D、氯化铝和少量氢氧化钠反应生成氢氧化铝沉淀,和过量氢氧化钠反应生成偏铝酸钠,没有沉淀,所以不选D。 本题难度:一般 2、选择题 下列离子方程式正确的是 |
参考答案:D
本题解析:金属钠与水反应:2Na +2H2O=2Na++2OH-+ H2↑,故A错误;金属铝投入NaOH溶液中:
2Al+2OH-+2H2O=2AlO2-+3H2↑,故B错误;稀硝酸中加入过量铁粉,生成Fe2+,故C错误;FeCl2酸性溶液放在空气中被氧气氧化为Fe3+,故D正确。
考点:本题考查离子方程式。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.钠与CuSO4溶液反应:2Na+Cu2+==2Na++Cu
B.钠加入水中:Na+2H2O==Na++2OH +H2↑
+H2↑
C.碳酸氢钠溶液中加入足量氢氧化钠溶液:HCO +OH
+OH ==CO
==CO +H2O
+H2O
D.漂白粉在空气中失效:ClO 十H2O+CO2==HCO
十H2O+CO2==HCO +HClO
+HClO
参考答案:C
本题解析:A.将假设钠与CuSO4溶液中,首先发生反应:2Na+2H2O=2Na++2OH-+H2↑;然后发生复分解反应:Cu2++2OH-Cu(OH)2↓,错误;B.钠加入水中:2Na+2H2O=2Na++2OH-+H2↑;错误;C.反应符合事实,拆写也符合离子方程式的书写原则,正确;D.漂白粉在空气中失效:Ca2++ClO 十H2O+CO2==CaCO3↓+HClO,错误。
十H2O+CO2==CaCO3↓+HClO,错误。
考点:考查离子方程式书写正误判断的知识。
本题难度:一般
4、填空题 (12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。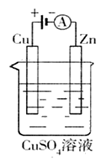
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是 ;
正极的电极反应式是 。
(3)下图是一个电化学过程示意图。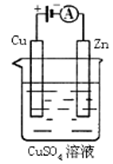
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
参考答案:(1)N2H4(1)+O2(g) =N2(g)+2H2O(1);△H=
本题解析:
本题难度:一般
5、填空题 (13分)铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题。
(1)工业上可用Cu2S+O2 2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:________________.CuSO4溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,则反应后的溶液中肯定有的离子是________________;若有红色固体,则反应后的溶液中肯定没有的离子是________,检验该离子的试剂为________。
(4)铁氰化钾 K3[Fe(CN)5]和亚铁氰化钾K4[Fe(CN)6] 的混合溶液可用于太阳能电池的电解液,该太阳能电池的工作原理示意图如图所示,其中催化剂a为________极,电极反应式为________;
参考答案:(1)1.2mol;(2)Cu+2H++H2O2=Cu2++2H2O;2Cu2++SO32-+2Cl- 2CuCl↓+SO42-+2H+;
2CuCl↓+SO42-+2H+;
(3)Fe2+、Cu2+;Fe3+;KSCN溶液;(4)负;[Fe(CN)6]4- -e-=[Fe(CN)6]3-
本题解析:(1)在Cu2S+O2 2Cu+SO2反应中,每有1mol的Cu2S发生反应,转移电子的物质的量是6mol,当消耗32 g Cu2S时,n(Cu2S)=32g÷160g/mol=0.2mol,所以转移电子的物质的量为n(e-)="0.2mol" ×6 =1.2mol;(2)在酸性条件下,H2O2将Cu氧化为Cu2+,它本身被还原为H2O,发生反应的离子方程式为:Cu+2H++H2O2=Cu2++2H2O;(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,会发生反应:2FeCl3+Cu=2FeCl2+CuCl2;取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,说明发生了反应: 2FeCl3+Fe=3FeCl2;没有发生Fe与Cu的置换反应,则反应后的溶液中肯定有的离子是Fe2+、Cu2+;若有红色固体,则该固体是Cu,由于Cu会和FeCl3发生反应:2FeCl3+Cu=2FeCl2+CuCl2;反应后得到了Cu,则溶液中肯定没有的离子是Fe3+;Fe3+与SCN-会发生显色反应,使溶液变为血红色,所以检验该离子的试剂为KSCN溶液;(4)根据图示可知催化剂a失去电子,是负极;电极反应式为[Fe(CN)6]4- -e-=[Fe(CN)6]3-。
2Cu+SO2反应中,每有1mol的Cu2S发生反应,转移电子的物质的量是6mol,当消耗32 g Cu2S时,n(Cu2S)=32g÷160g/mol=0.2mol,所以转移电子的物质的量为n(e-)="0.2mol" ×6 =1.2mol;(2)在酸性条件下,H2O2将Cu氧化为Cu2+,它本身被还原为H2O,发生反应的离子方程式为:Cu+2H++H2O2=Cu2++2H2O;(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,会发生反应:2FeCl3+Cu=2FeCl2+CuCl2;取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,说明发生了反应: 2FeCl3+Fe=3FeCl2;没有发生Fe与Cu的置换反应,则反应后的溶液中肯定有的离子是Fe2+、Cu2+;若有红色固体,则该固体是Cu,由于Cu会和FeCl3发生反应:2FeCl3+Cu=2FeCl2+CuCl2;反应后得到了Cu,则溶液中肯定没有的离子是Fe3+;Fe3+与SCN-会发生显色反应,使溶液变为血红色,所以检验该离子的试剂为KSCN溶液;(4)根据图示可知催化剂a失去电子,是负极;电极反应式为[Fe(CN)6]4- -e-=[Fe(CN)6]3-。
考点:考查氧化还原反应中物质的作用及电子转移的计算、离子的检验、存在、离子方程式的书写即原电池反应原理中电极的判断、电极反应式的书写的知识。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《元素周期律.. | |