| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡》答题技巧(2019年最新版)(八)
参考答案:A 本题解析:①单位时间内生成nmol O2代表正反应速率,同时生成2n mol NO2,代表逆反应速率,且符合化学计量数之比,可以作为平衡状态的标志,正确;②单位时间内生成n mol O2的同时生成2n mol NO,表示的都是正反应速率,不能作为平衡状态的标志,错误;排除B、D;③用NO2、NO、O2表示的反应速率之比为2∶2∶1,反应速率之比始终等于化学计量数之比,不能作为平衡状态的标志,错误,排除C;④⑥⑦都是随反应的进行而改变的量,当达到平衡时,不再改变,可以作为平衡状态的标志,所以答案选A。 本题难度:一般 4、选择题 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是( ? ) |
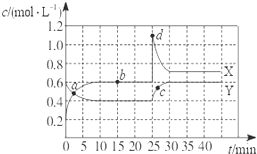
参考答案:D
本题解析:
本题难度:简单
5、选择题 反应H2(g)+I2(g)  2HI(g)的平衡常数为K1;反应HI(g)
2HI(g)的平衡常数为K1;反应HI(g) 1/2H2(g)+1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值( )
1/2H2(g)+1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值( )
A.K1=2K2
B.K1=1/ K22
C.K1=K22
D.K1=1/2K2
参考答案:B
本题解析:K1=C(HI)2/C(H2)C(I2) K2=C(H2)0.5C(I2)0.5/C(HI) K1=1/K22
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《化学反应与.. | |