1、简答题 某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题.
| 检验次数 | 溶液中检验出的物质
第一次
KCl、K2SO4、Na2CO3、NH4Cl
第二次
NH4Cl、BaCl2、Na2SO4、K2CO3
第三次
Na2SO4、NH4Cl、K2CO3、NaCl
|
(1)三次检验结果中第______次检验结果不正确.
(2)检验时,为了证明溶液中存在SO42-、Cl-、CO32-,进行下列实验:(填写下列空白)
| 步骤 | 实验操作 | 预期现象及结论
1
向溶液中滴加______(填化学式)溶液至过量
______
2
______
______
3
过滤,再向滤液中加入______(填化学式)溶液
______
|
(3)步骤1中溶液滴加过量的目的是______;如何判断步骤2中的溶液已加过量______.
参考答案:(1)第二次中BaCl2和Na2SO4发生反应,不可能共存,检验结果不正确,故答案为:二;
(2)首先可加入HNO3,如有气体生成,说明溶液中含有CO32-,
其次加入Ba(NO3)2溶液至过量,可用来检验溶液中是否含有SO42-,可通过是否有沉淀来判断,
最后向溶液中加入AgNO3,如产生白色沉淀,证明溶液中含Cl-.
故答案为:
步骤实验操作预期现象及结论1HNO3?有气体生成,证明溶液中含有CO32-2向上述溶液中滴加Ba(NO3)2溶液至过量产生白色沉淀,证明溶液中含SO42-?3AgNO3产生白色沉淀,证明溶液中含Cl-?(3)加入过量硝酸,可使碳酸盐完全转化为二氧化碳气体,保证不影响第二步实验,在第二步实验中可通过往上层清液中继续滴加Ba(NO3)2溶液,若无白色沉淀生成,则Ba(NO3)2溶液已滴加过量,
故答案为:除尽溶液中的CO32-,以免干扰下一步实验;静置,往上层清液中继续滴加Ba(NO3)2溶液,若无白色沉淀生成,则Ba(NO3)2溶液已滴加过量.
本题解析:
本题难度:一般
2、实验题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下图所示装置,在硬质玻璃 管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。

请完成该实验中的问题:
(1)写出该反应的化学方程式:________________。该氧化还原反应的还原剂是_______,氧化剂是___________。
(2)实验前必须对整套装置进行气密性检查,操作方法是_______________
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是___________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是___________________
(4)酒精灯和酒精喷灯点燃的先后顺序是________________ ,为什么?___________________
(5)干燥管中盛装的物质是___________,作用是_______________
(6)试管中收集的气体是___________。如果要在A处的玻璃管处点燃该气体,则必须对该气体进行___________,方法是_______________。这一操作的目的是____________________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2;Fe;H2O
Fe3O4+4H2;Fe;H2O
(2)在右侧导管口处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气泡逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则表明该套装置气密性良好
(3)提供持续不断的水蒸气;防止暴沸事故的发生
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止先点燃酒精喷灯导致Fe与O2的反应
(5)碱石灰干燥剂;除去反应产生的H2中混有的水蒸气
(6)H2;验纯;用试管收集一试管气体,管口向下(用拇指堵住管口)靠近酒精灯火焰,点燃,如果发出爆鸣声,则证明产生的氢气不纯(含有氧气),如果发出“噗”的声音,则证明是纯净的氢气;防止点燃时,因氢气中含有氧气而爆炸
本题解析:
本题难度:一般
3、实验题 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3?假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__??。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由?.
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式?。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg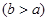 ,则混合物中Cu2O的质量分数为?。
,则混合物中Cu2O的质量分数为?。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
物?质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
|
?
实验室有下列试剂可供选择: A.氯水? B.H2O2? C.NaOH ? D.Cu2(OH)2CO3
实验小组设计如下实验方案:
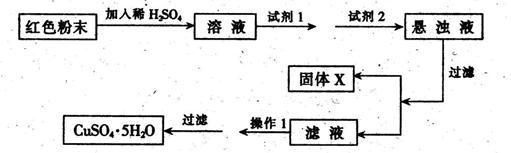
试回答:①试剂1为___?_,试剂2为?(填字母)。
②固体X的化学式为____,③操作I为_?。
参考答案:
(1)固体完全溶解,溶液变为红色;(2)不合理?红色粉末若是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,滴加KSCN试剂后溶液可能不变红色,
(3)10:9? Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
(4)[9(b?a) ]/a ×100%;(5)①B、D②Fe(OH)3?蒸发浓缩 ,冷却结晶
本题解析:(1)若红色粉末是Fe2O3,Fe2O3与硫酸反应生成硫酸铁,没有红色不溶物,滴加KSCN溶液,溶液变为红色;(2)红色粉末若是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,滴加KSCN试剂后溶液可能不变红色,所以说法不合理;(3)因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+;溶液不变红,且无固体残留,即为恰好完全反应,氧化铁和氧化亚铜的物质的量比值为1:1,质量比:10:9。
(4)Cu2O~~~2CuO?质量增重△w?
144 g? 16 g?
m(Cu2O)?(b-a) g?
所以m(Cu2O)=[144g×(b?a)g ]:16g =9(b-a)g,
故混合物中Cu2O的质量分数为[9(b?a) ]/a ×100%;
(5)红色粉末为Fe2O3和Cu2O的混合物,由工艺流程可知,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,所得的溶液含有Fe2+,加入试剂1目的是Fe2+将为Fe3+,氯气会引入氯离子,故试剂1应选择B.H2O2;加入试剂2目的是调节溶液的PH值使Fe3+转化为Fe(OH)3沉淀除去,过滤得到硫酸铜溶液,氢氧化钠会引入钠离子,故试剂2应选择Cu2(OH)2CO3,得到的沉淀x为Fe(OH)3,接下来蒸发浓缩,冷却结晶。
本题难度:一般
4、实验题 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
1、[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:
①切口断面处先产生气泡,反应由慢到快;
②小块合金在溶液中上下翻腾;
③溶液升温;
④反应后,溶液中残留黑色黑体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是__________________。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。

2、[实验二]向实验一的锥形瓶里滴加1mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:______________________。
3、[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加amLC1mol·L-1NaOH之后,改成滴加C2mol·L-1
HCl,所得沉淀Y(mol)与试剂总体积 V(mL)间的关系如图所示。据此,回答下列问题:

(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则C1/C2=___________;
(2)所加入NaOH溶液的体积a=______________mL。
参考答案:1、(2)合金表面有氧化膜;
(3)②测定残留固体镁的质量(或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量”)
2、AlO2-+4H+=Al3++2H2O
3、(1)C1/C2=2或2:1;(2)7
本题解析:
本题难度:困难
5、实验题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有____________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_______________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是____________________________ ;
?(4)要加快上述实验中气体产生的速率,还可采取的措施有_______________________(答两种);
?(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。

①请完成此实验设计,其中:V1=__________,V6=_______?V9=__________,
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈_____________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因____________________________________。
参考答案:(1)Zn+CuSO4=ZnSO4十Cu、Zn+ H2SO4= ZnSO4十H2↑
(2)CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn微电池,加快了氢气产生的速率
(3)Ag2SO4
(4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种)
(5)①30;10;17.5 ②灰黑;暗红 ③当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积
本题解析:
本题难度:一般