|
高中化学知识点讲解《原电池原理》试题巩固(2019年最新版)(四)
2020-08-13 04:34:53
【 大 中 小】
|
1、选择题 用电解法提取氯化铜废液中的铜,方案正确的是( )
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
参考答案:A、用电解法提取氯化铜废液中的铜时,铜必需作阴极,这样可以达到回收铜的目的,故A错;
B、电解时阳极可用铜或惰性电极(碳棒),但铜应作阴极,故B正确;
C、阴极产物为铜,和氢氧化钠溶液不反应,故C错;
D、阳极产物为氯气,不能用带火星的木条检验,二者不反应,故D错.
故选B.
本题解析:
本题难度:简单
2、选择题 如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液,片刻后可观察到的现象是(指悬吊的金属圈)( )
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
| 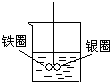
参考答案:铁圈和银圈连接浸入硫酸铜溶液中,该装置构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,负极上铁失电子生成亚铁离子进入溶液,所以铁圈质量减少;银圈上铜离子得电子生成铜单质附着在银圈上,导致银圈质量增加,所以观察到的现象是:银圈向下倾斜.
故选D.
本题解析:
本题难度:简单
3、简答题 (12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
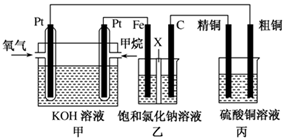
(1)甲烷燃料电池负极反应式是?;
(2)石墨(C)极的电极反应式为?;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成?的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。

若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
参考答案:(12分) (1)? CH4 +10OH- -8e-=CO32-+7H2O ;(3分)
(2)2Cl--2e-=Cl2↑;(2分) (3)4.48L,(2分) 12.8g;(2分)
(4)?负(1分) 饱和氯化钠溶液或食盐水(1分)?铁 (1分)
本题解析:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极。
(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,氧气的物质的量是2.24L÷22.4L/mol÷0.1mol,则则转移电子的物质的量=0.1mol×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg,则
2H++2e-=H2↑
2mol ?22.4L
0.4mol ?xL
解得x=4.48
Cu 2++2e-=Cu
2mol? 64g
0.4mol? yg
解得y=12.8
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极,所以a为电池负极;若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,如果阳极是惰性电极,阳极上氢氧根离子放电生成氧气得不到氢氧化亚铁,所以阳极上应该是铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁。
本题难度:一般
4、选择题 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A.钢板为正极,发生还原反应
B.放电时电子的流向:正极→导线→负极
C.放电时OH-向正极移动
D.总反应为:2Li+2H+ 2Li++H2↑ 2Li++H2↑
参考答案:A
本题解析:电极反应为(—)2Li-2e- 2Li+,(+)2H2O+2e- 2Li+,(+)2H2O+2e- 2OH-+H2↑,故钢板为正极,发生还原反应,A正确;原电池电子的流向:负极→导线→正极,B错误;原电池阴离子向负极移动,C错误;锂水电池的总反应为2Li+2H2O 2OH-+H2↑,故钢板为正极,发生还原反应,A正确;原电池电子的流向:负极→导线→正极,B错误;原电池阴离子向负极移动,C错误;锂水电池的总反应为2Li+2H2O 2LiOH+H2↑,D错误。 2LiOH+H2↑,D错误。
本题难度:一般
5、选择题 如下图所示为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述不正确的是(?)
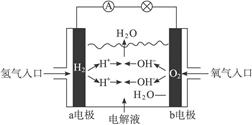
A.a电极是负极
B.b电极的电极反应为:4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
参考答案:B
本题解析:原电池中分解失去电子,发生氧化反应,逐渐得到电子,发生还原反应。A项H2失电子变成H+,作负极。B项电极反应式应该是O2+4e-+2H2O====4OH-,作正极,选项B不正确。C项绿色电源即无污染电源。D项正确,所以正确的答案选B。
本题难度:一般
| 