1、简答题 今欲用NaOH固体配制250mL?0.2mol/L的NaOH溶液.
(1)某同学配制过程中移液操作如图,其中可见两处错误:①______?②______
(2)用______(填滤纸或小烧杯)在托盘天平上称取______?NaOH固体.
(3)配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.
(4)以下因素会造成实验结果偏低的是______
A.容量瓶中原来有少量蒸馏水?B.定容时观察液面俯视
C.忘记洗涤?D.定容时观察液面仰视.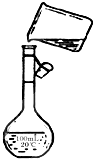
参考答案:(1)配制过程中应通过玻璃棒引流,防止液体洒落,容量瓶的规格为100mL,与配制溶液的体积不一致,故答案为:未用玻璃棒引流;容量瓶的规格与配制溶液的体积不一致;
(2)由于氢氧化钠具有腐蚀性,所以要放到烧杯中称量,m(NaOH)=nM=cvM=0.5mol/L×0.1L×40mol/mol=2.0g,故答案为:小烧杯;2g;
(3)因容量瓶不能存放溶液,所以配制好的溶液不能长期存放在容量瓶中,故答案为:不能;
(4)A.容量瓶中原来有少量蒸馏水,对溶液的体积无影响,浓度不变,故A错误;
B.定容时观察液面俯视,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故B错误;
C.忘记洗涤,因烧杯和玻璃棒上占有溶质,溶质的质量偏少,浓度偏低,故C正确;
D.定容时观察液面仰视,溶液的液面高于刻度线,溶液的体积偏大,浓度偏低,故D正确;
故答案为:CD.
本题解析:
本题难度:一般
2、实验题 甲、乙两同学进行化学研究性学习:测定某次雨水的pH并判断某次雨水是否为酸雨。
甲同学取pH试纸用蒸馏水湿润后置于表面皿中,取雨水少量并滴几滴雨水到pH试纸上,稍许,与标准比色卡对照,测得pH为6。由此,甲同学得出这次雨水不是酸雨的结论。
乙同学用烧杯取雨水少许,用pH试纸正确测定该雨水的pH,测得pH为5。露置于教室中一段时间后,再测得pH为4。
请回答下列问题:
(1)甲、乙两同学上述化学研究性学习思路的可取之处是_________________________。
(2)你认为甲同学的结论是否合理并说明你的理由_________________________。
(3)请你解释乙同学的实验中先测得pH为5,露置于教室中一段时间后,再测得pH为4的原因(用化学方式式并结合文字说明)__________________________
(4)酸雨形成的原因与下列那些气体有关________(填代号)
A:CO2 B:SO2 C:CO D:NO2
参考答案:(1)通过实验的方法来解决化学问题
(2)结论不合理,甲同学测定雨水的pH前将pH试纸用蒸馏水湿润,相当于将雨水进行稀释
(3)2H2SO3+O2==2H2SO4,生成H2SO4是强酸使酸性增强
(4)BD
本题解析:
本题难度:一般
3、选择题 用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
参考答案:AB
本题解析:
本题难度:简单
4、简答题 (1)用已知物质的量浓度的酸来测定未知物质的量浓度的碱,滴定时:用左手______,右手______,眼睛应紧盯______,当最后一滴刚好使指示剂颜色发生明显的改变而且______内不恢复原来的颜色,即为滴定终点.
(2)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是______.
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大.
参考答案:(1)滴定时:用左手控制活塞,右手不断旋转振荡锥形瓶,眼睛应注意锥形瓶中溶液颜色变化,当最后一滴刚好使指示剂颜色发生明显的改变而且半分钟内不恢复原来的颜色,即为滴定终点,故答案为:控制活塞;不断旋转振荡锥形瓶;锥形瓶中溶液颜色变化;半分钟;
(2)A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏,否则会造成误差,故A正确;
B.容量瓶的规格没有60mL,实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶,故B正确;
C.容量瓶中含有少量蒸馏水,待测液的物质的量不变,对V(标)无影响,根据c(待)=c(标)×V(标)V(待)可知c(待)不变,故C错误;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,标准液浓度降低,造成V(标)偏大,根据c(待)=c(标)×V(标)V(待)可知c(待)偏大,故D正确;
E.酸滴定碱,用甲基橙作指示剂,溶液颜色从黄色变为橙色,故E错误;
F.配制溶液定容时,俯视容量瓶刻度线,溶液的体积偏小,导致配制溶液的浓度偏高;中和滴定实验中在最后一次读数均俯视读数,读数偏小,造成V(标)偏小,根据c(待)=c(标)×V(标)V(待)可知c(待)偏小,故F错误;
故选:A、B、D
本题解析:
本题难度:简单
5、填空题 某学生欲用已知物质的量浓度的盐酸来滴定并测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填空:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______,直到因加入一滴盐酸后,溶液由______变为______,并且半分钟内不恢复.
(2)下列操作中,可能使所测氢氧化钠溶液的浓度值偏低的是______
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠
溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)
滴定前刻度
滴定后刻度
溶液体积/mL
第一次
25.00
0.00
26.11
26.11
第二次
25.00
1.56
30.30
28.74
第三次
25.00
0.22
26.31
26.09
|
请选用其中合理的数据计算出该氢氧化钠溶液的物质的量浓度:c(NaOH)=______.
参考答案:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由红色突变为无色,且半分钟内不褪色,且半分钟内不褪色,
故答案为:锥形瓶中溶液颜色的变化;红色;无色;
(2)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏大,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏大,故C错误;
D.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏低,故D正确;
故选D;
(3)根据数据的有效性,舍去第2组数据,则1、3组平均消耗V(盐酸)=26.11mL+26.09mL2=26.10mL,
根据反应方程式 HCl+NaOH═NaCl+H2O
0.0261L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=0.0261L×0.1000mol/L0.025L=0.1044mol/L,
故答案为:0.1044mol/L.
本题解析:
本题难度:一般