1、选择题 下列有关离子检验的方法正确的是
A.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl-
B.某溶液中加入氢氧化钠溶液立即有白色沉淀产生,该溶液中一定有Al3+
C.某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32-
D.某溶液中加入稀盐酸无现象,加入氯化钡溶液有白色溶液产生,该溶液中一定有SO42-
参考答案:D
本题解析:A、和银离子反应生成白色沉淀的可以是氯离子、SO42-或CO32-,错误;B、能和NaOH反应生成白色沉淀的可以是氢氧化镁或氢氧化铝,错误;C、加入稀盐酸能产生气体使澄清石灰水变浑浊的可以是CO2和SO2,因此可以是碳酸根、碳酸氢根、亚硫酸根、亚硫酸氢根,错误;D、加入BaCl2产生白色沉淀,可以是氯化银或硫酸钡,错误。
本题难度:一般
2、选择题 下列各组混合物可用如图装置分离的是
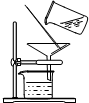
A.汽油和植物油
B.碳酸钙和水
C.酒精和水
D.四氯化碳和碘
参考答案:B
本题解析:由图可知,该装置为过滤装置,用于固液分离。A选项,为两种不相容的液体,应用分液进行分离,错误。B选项,正确,碳酸钙难溶于水,典型固液分离。C选项,两种混溶且沸点不同的液体,应蒸馏分离。D选项,碘与四氯化碳,应萃取的方式分离。
本题难度:一般
3、选择题 如图各装置不能达到实验目的的是
 ?
? ?
?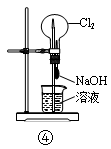
A.装置①可用于从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B.装置②可用于干燥、收集氨气,并吸收多余的氨气
C.装置③可用于排空气法收集NO2气体
D.装置④可用于证明Cl2易与NaOH溶液反应
参考答案:A
本题解析:A.胶体的粒子能透过滤纸,因此不能从Fe(OH)3胶体中过滤出Fe(OH)3胶粒。错误。B. 氨气是碱性气体,可以用碱性干燥剂碱石灰干燥。由于氨气的密度比空气小,所以用向上排空气法收集。氨气是大气污染物,要进行尾气处理。由于氨气极容易溶解于水,为了使氨气被充分吸收又防止倒吸现象的发生,常在导气管的末端按一个倒扣的漏斗。正确。C. NO2容易与水发生反应:3NO2+ H2O == 2HNO3+ NO。所以它只能用排空气法收集。由于NO2的密度比空气大,所以用向上排空气法收集。正确。D.如果Cl2易与NaOH溶液反应,就会使烧瓶中的气体压强减小,这时烧杯中的NaOH溶液就会在大气压强的作用下被压入烧瓶,气体继续反应,导致烧瓶内外又产生压强差,这样NaOH溶液不断进入到烧瓶而形成喷泉。如果Cl2与NaOH溶液不容易发生反应,就不会形成喷泉实验。正确。
本题难度:一般
4、选择题 只用下列试剂中的一种就能鉴别Ba(NO3)2、Na2CO3、K2SO4三种溶液,则该试剂是
A.KNO3溶液
B.稀H2SO4
C.NaOH溶液
D.Na2SO4溶液
参考答案:B
本题解析:略
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,0.2NA个H2分子的质量为0.4g
B.4.4?g?CO2含有的原子数为3?NA
C.标准状况下,18?g?H2O占有的体积约为22.4?L
D.物质的量浓度为0.5?mol/L的NaCl溶液中,含有Cl-个数为0.5NA
参考答案:A
本题解析:分析:A.常温常压下,0.2NA个H2分子的物质的量为0.2mol;
B.4.4?g?CO2的物质的量为0.1mol;
C.18?g?H2O的物质的量为1mol,水在标准状况下为液态;
D.缺少溶液的体积;
解答:A.常温常压下,0.2NA个H2分子的物质的量为n=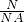 =
=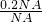 =0.2mol,0.2mol的氢气的质量为 m=n×M=0.2mol×2g/mol=0.4g,故A正确;
=0.2mol,0.2mol的氢气的质量为 m=n×M=0.2mol×2g/mol=0.4g,故A正确;
B.4.4?g?CO2的物质的量为n= =
=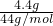 =0.1mol,1mol CO2的含有3 mol原子,0.1mol CO2的含有0.3 mol原子,根据N=n×NA=0.3mol×NAmol-1=0.3?NA,故B错误;
=0.1mol,1mol CO2的含有3 mol原子,0.1mol CO2的含有0.3 mol原子,根据N=n×NA=0.3mol×NAmol-1=0.3?NA,故B错误;
C.标准状况下,18?g?H2O的物质的量为n= =
= =1mol,因水在标准状况下为液态,所以不能用Vm=22.4mol/L,所以标准状况下,18 g H2O占有的体积不为22.4 L,故C错误;
=1mol,因水在标准状况下为液态,所以不能用Vm=22.4mol/L,所以标准状况下,18 g H2O占有的体积不为22.4 L,故C错误;
D.物质的量浓度为0.5?mol/L的NaCl溶液中,氯化钠的物质的量为n=C×V,该题未知溶液的体积,所以无法求解,故D错误;
故选A.
点评:本题考查了阿伏加德罗常数的有关计算,掌握相关的公式并能熟练运用是解答的关键,题目较简单.
本题难度:一般