| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《影响化学反应速率的因素》在线测试(2019年最新版)(八)
参考答案:C 本题解析:A、图1中,温度升高,甲醇的含量减少,可以判读反应为放热反应,不选A;B、由于反应是放热反应,不选B;C、将容器c中的平衡状态转变到容器d的平衡态,需要降低甲醇的含量,平衡逆向移动,可采取升温或减压,选C;D、反应进行到5分钟,T3达到平衡,a、b没有达到平衡,平衡正向移动,d、e达到了平衡,不选D。 本题难度:困难 4、填空题 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ; (3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1; (4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。  参考答案:(1)16H++5H2C2O4+2MnO4 -=2Mn2++10CO2↑+8H2O (2)②③;①② (3)0.010或1.0×10-2 本题解析:(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,则离子方程式为16H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O,故答案为:16H++5H2C2O4+2MnO4 -=2Mn2++10CO2↑+8H2O; 本题难度:一般 5、填空题 ( 8分 )向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题: | |||||||||||||||||||||||||||||
参考答案:(1) v2> v1>v3 (2)AC (3)25g (4)01.5 mol·L-1·min-1
本题解析:(1)反应速率越快,反映在曲线上,斜率就越大,所以根据图像可知反应速率从大到小的顺序为v2> v1>v3。
(2)要减小反应速率,可以通过降低盐酸的浓度、或降低反应的温度,所以答案选AC。B不影响,D是加快反应速率。
(3)最终生成CO2的体积是5.60L,物质的量是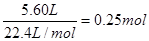 。根据碳原子守恒可知碳酸钙的物质的量也是0.25mol,质量是0.25mol×100g/mol=25g。
。根据碳原子守恒可知碳酸钙的物质的量也是0.25mol,质量是0.25mol×100g/mol=25g。
(4)EF段共收集到CO2是4.48L-1.12L=3.36L。物质的量是0.15mol,则消耗氯化氢是0.15mol×2=0.3mol,所以盐酸的反应速率是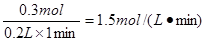 。
。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《有关氧化还.. | |