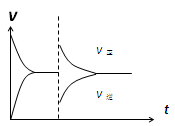
1、选择题 反应:L(s)+aG(g) bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。

据此可判断(? )
A.上述反应是放热反应? B.上述反应是吸热反应?
C.a>b?D.a +1<b
参考答案:B
本题解析:由图可知,随温度升高,G的体积分数减少,即升高温度平衡向正反应方向移动,即可得正反应方向为吸热反应,A错,B正确;
由图可知,随压强的增大,G的体积分数增大,即增大压强平衡向逆反应方向移动,即逆反应为气体体积减少的反应,得a <b,C、D均错;
本题难度:一般
2、选择题 将1 molCO和1 molH2O混合在一定条件下反应: CO+H2O(气) CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
A.11.5倍
B.5.75倍
C.23倍
D.30.67倍
参考答案:A
本题解析:根据反应的方程式可知,反应前后体积不变,所以混合气的平均相对分子质量是(28+18)÷2=23。由于气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气的23÷2=11.5倍,答案选A。
本题难度:一般
3、选择题 下列措施或事实不能用勒夏特列原理解释的是 (? )
A.新制的氯水在光照下颜色变浅
B.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
C.在合成氨的反应中,降温或加压有利于氨的合成
D.H2、I2、HI平衡混合气加压后颜色变深
参考答案:D
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系,所以选项A、B、C都是正确的。D中反应前后体积不变,增大压强,浓度增大,颜色加深,但平衡不移动,不能用勒夏特列原理解释,答案选D。
点评:该题是基础性试题的考查,试题难易适中,灵活性强,注重能力的考查和训练。有利于培养学生的灵活应变能力和逻辑推理能力。
本题难度:简单
4、简答题 在一定温度下,10L密闭容器中加入5molSO2、4molO2,经10min后反应达平衡时有3molSO2发生了反应.试计算:
(1)用SO2表示该反应的反应速率为多少?
(2)O2的转化率为多少?
(3)平衡常数K为多少?
参考答案:
本题解析:
本题难度:一般
5、选择题 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是(?)
CO2(g)+H2(g)。CO2的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是(?)

A.反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH>0
CO2(g)+H2(g)的ΔH>0
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.恒压密闭容器中通入1mol CO(g)和1mol H2O(g),发生上述反应,当反应达到平衡后,在其他条件不变时,再通入1mol H2O(g)和1mol CO(g)的混合气体,v正、v逆反应速率随时间t变化的示意图如下。